KALETRA
ABBVIE
Cápsulas y solución
Denominación genérica: Lopinavir/ritonavir.
Forma farmacéutica y formulación: Cápsulas, solución. Cada cápsula contiene: lopinavir 133,3 mg, ritonavir 33,3 mg. Excipientes, cbp 1 cápsula. Cada 100 ml contienen: lopinavir 8 g, ritonavir 2 g. Vehículo, cbp 100 ml.
Indicaciones terapéuticas: KALETRA está indicado en combinación con otros agentes antirretrovirales para el tratamiento de la infección por VIH. Esta indicación se basa en el análisis de los niveles plasmáticos del ARN del VIH y los conteos de células CD4+ en un estudio controlado con lopinavir/ritonavir, de 48 semanas de duración, y en estudios adicionales con KALETRA, de 360 semanas de duración. Aún no se tienen resultados de estudios que evalúan el efecto de KALETRA sobre la progresión del VIH. La administración de KALETRA una vez al día no ha sido estudiada en pacientes con experiencia previa a antirretrovirales.
Farmacocinética y farmacodinamia: Farmacocinética: las propiedades farmacocinéticas de lopinavir coadministrado con ritonavir han sido evaluadas en voluntarios adultos sanos y en pacientes infectados con VIH; no se observaron diferencias sustanciales entre los dos grupos. Lopinavir se metaboliza por completo esencialmente por el CYP3A. Ritonavir inhibe el metabolismo de lopinavir; por tanto, incrementa los niveles plasmáticos de lopinavir. A través de los estudios, la administración de KALETRA 400/100 mg, dos veces al día, produjo concentraciones plasmáticas promedio de lopinavir, en estado de equilibrio, 15 a 20 veces más altas que las de ritonavir en pacientes infectados por VIH. Los niveles plasmáticos de ritonavir son menos del 7% de aquellos obtenidos después de una dosis de ritonavir de 600 mg, dos veces al día. La CE50 antiviral de lopinavir in vitro es aproximadamente 10 veces más baja que la de ritonavir. Por tanto, la actividad antiviral de KALETRA se debe a lopinavir. Absorción: en un estudio farmacocinético en sujetos VIH-positivos (n=19), sin restricción en la dieta, la dosificación múltiple con KALETRA 400/100 mg, cada 12 horas, durante 3 a 4 semanas, produjo una concentración plasmática máxima promedio ± DE de lopinavir (Cmáx) de 9,8 ± 3,7 mg/ml. El ABC de lopinavir, durante un intervalo de dosificación de 12 horas, tuvo un promedio de 92,6 ± 36,7 mg•h/ml. No se ha establecido la biodisponibilidad absoluta de lopinavir coformulado con ritonavir, en humanos. Efectos de los alimentos sobre la absorción oral: las cápsulas y la solución de KALETRA coformulado, fueron bioequivalentes bajo condiciones de no ayuno (comidas moderadas en grasa). La administración de una dosis única de 400/100 mg de KALETRA cápsulas junto con una comida moderada en grasa (500 a 682 kcal, 23 a 25% de calorías derivadas de grasa), se asoció con un incremento promedio de 48% y 23% en el ABC y la Cmáx de lopinavir, respectivamente, en relación con los valores en ayunas. Para la solución de KALETRA, los incrementos correspondientes en el ABC y la Cmáx de lopinavir fueron 80 y 54%, respectivamente. La administración de KALETRA con una comida rica en grasa (872 kcal, 56% derivadas de grasa) incrementó el ABC y la Cmáx de lopinavir 97% y 43%, respectivamente para las cápsulas, y 130% y 56%, respectivamente, para la solución. Para aumentar la biodisponibilidad y minimizar la variabilidad, KALETRA se debe tomar junto con los alimentos. Distribución: en estado de equilibrio, lopinavir se une aproximadamente en un 98 a 99% a las proteínas séricas; la proteína de unión de alta afinidad es la glucoproteína alfa-1-ácida (AAG) y albúmina. En estado de equilibrio, la unión de lopinavir a las proteínas permanece constante en el rango de concentraciones observadas después de 400/100 mg de KALETRA, dos veces al día, y es similar entre sujetos sanos y VIH-positivos. Metabolismo: experimentos in vitro con microsomas hepáticos humanos indican que lopinavir sufre metabolismo hepático oxidativo, principalmente por el sistema del citocromo P-450, casi exclusivamente por la isoenzima CYP3A. Como es un potente inhibidor del CYP3A, entonces inhibe el metabolismo de lopinavir e incrementa sus niveles plasmáticos. Un estudio con lopinavir marcado con 14C en humanos mostró que el 89% de la radioactividad en plasma, después de una dosis única de 400/100 mg de KALETRA, fue debida al fármaco original. En el hombre se han identificado por lo menos 13 metabolitos oxidativos de lopinavir. Ritonavir ha mostrado inducir las enzimas metabólicas, lo que resulta en la inducción de su propio metabolismo. Las concentraciones pre-dosis de lopinavir declinan con el tiempo durante la dosificación múltiple, y se estabilizan aproximadamente después de 10 a 16 días. Eliminación: después de una dosis de 400/100 mg de 14C-lopinavir/ritonavir, aproximadamente el 10,4 ± 2,3% y el 82,6 ± 2,5% se puede encontrar en la orina y las heces, respectivamente después de 8 días. Lopinavir sin cambios corresponde a 2,2% y 19,8% en la orina y las heces, respectivamente. Después de dosificación múltiple, menos del 3% de la dosis de lopinavir se excreta sin cambios en la orina. La depuración aparente (CL/F) de lopinavir oral es de 5,98 ± 5,75 l/h (promedio ± DE, n=19). Dosificación una vez al día: la farmacocinética de KALETRA una vez al día se evaluó en pacientes VIH+ sin tratamiento antirretroviral previo. KALETRA 800/200 mg se administró en combinación con emtricitabina 200 mg y tenofovir DF 300 mg como parte del tratamiento diario. Seis horas después de la administración de KALETRA 800/200 mg una vez al día en dosis multiples con alimentos por 4 semanas, se produjo una concentración plasmática máxima (Cmáx) en promedio ± de de lopinavir de 11,8 ± 3,7 mg/ml. La concentración valle de lopinavir promedio en estado estable previo a la dosis matutina fue de 3,2 ± 2,1 mg/ml y la concentración mínima dentro del intervalo de dosificación fue de 1,7 ± 1,6 mg/ml. El área bajo la curava de lopinavir en un intervalo de dosificación de 24 h promedió 154,1 ± 61,4 mg•h/ml. Poblaciones especiales: sexo, raza y edad: no se ha estudiado la farmacocinética de lopinavir en pacientes ancianos. No se han observado diferencias farmacocinéticas relacionadas con la edad o el sexo en pacientes adultos. No se han identificado diferencias farmacocinéticas debidas a la raza. Pacientes pediátricos: la farmacocinética de KALETRA ha sido estudiada en un total de 53 pacientes pediátricos, con rango de edad entre 6 meses a 12 años. El esquema de 230/57,5 mg/m2 c/12 h sin nevirapina y el esquema de 300/75 mg/m2 c/12 h con nevirapina mostró concentraciones de lopinavir en plasma similares a las obtenidas en pacientes adultos que recibieron un esquema de 400/100 mg c/12 horas (sin nevirapina). KALETRA en dosis una vez al día no ha sido estudiado en pacientes pediátricos. Insuficiencia renal: no se ha estudiado la farmacocinética de KALETRA en pacientes con insuficiencia renal; sin embargo, ya que la depuración renal de lopinavir es mínima, no se espera una disminución en la depuración corporal total en pacientes con insuficiencia renal. Insuficiencia hepática: KALETRA se metaboliza y elimina principalmente por el hígado. La dosificación múltiple de KALETRA 400/100 mg dos veces al día a pacientes VIH y VHC coinfectados, con insuficiencia hepática leve a moderada, ocasionó un aumento de 30% en el ABC del lopinavir y 20% de aumento en la Cmáx, comparada con sujetos infectados por VIH y con función hepática normal. Además, la unión a las proteínas plasmáticas de lopinavir fue menor en caso de insuficiencia hepática leve y moderada, comparado con los controles (99,09 vs. 99,31%, respectivamente). KALETRA no se ha estudiado en pacientes con insuficiencia hepática severa (ver Precauciones). Farmacodinamia: microbiología: mecanismo de acción: lopinavir es un inhibidor de las proteasas del VIH-1 y VIH-2. La inhibición de la proteasa del VIH impide la división de la poliproteína gag-pol, lo que genera la producción de virus inmaduros, no infecciosos. Actividad antiviral in vitro: la actividad antiviral de lopinavir in vitro contra cepas clínicas de VIH de laboratorio, fue evaluada en líneas celulares linfoblásticas infectadas agudamente y linfocitos de sangre periférica, respectivamente. En ausencia de suero humano, la CE50 promedio de lopinavir contra cinco cepas diferentes de laboratorio de VIH-1 y una VIH-2 fue de 10 a 27 nM (0,006 a 0,017 mg/ml, 1mg/ml igual a 1,6 mcM) y en rango de de 4 a 11 nM (0,003 a 0,007 mg/ml). En presencia de suero humano al 50%, las CE50 promedio de lopinavir contra estas cinco cepas de laboratorio oscilaron de 65 a 289 nM (0,04 a 0,18 mg/ml).Los estudios de actividad de combinación de medicamentos con lopinavir y otros inhibidores de la proteasa o inhibidores de la transcriptasa inversa no se han completado aún. Resistencia: han sido seleccionados aislados de VIH-1 in vitro, con sensibilidad reducida a lopinavir. La presencia de ritonavir no parece influir en la selección de virus resistentes a lopinavir in vitro. La selección de resistencia a KALETRA en pacientes sin experiencia previa a antirretrovirales no se ha identificado. Se ha observado resistencia a KALETRA en pacientes tratados con otros inhibidores de proteasa previos. La selección de resistencia a KALETRA en el tratamiento de pacientes pediátricos sin tratamiento previo parece ser consistente con la de los adultos. No existen aun datos suficientes que permitan identificar patrones de mutaciones a lopinavir en pacientes bajo tratamiento con KALETRA. La evaluación de este patrón de mutaciones está siendo estudiada. Resistencia cruzada: se dispone de poca información sobre resistencia cruzada de virus seleccionados durante el tratamiento con KALETRA. En cuatro pacientes previamente tratados con uno o más inhibidores de proteasa que desarrollaron resistencia fenotípica a lopinavir durante la terapia con KALETRA permanecieron con resistencia cruzada o la desarrollaron a ritonavir, indinavir y nelfinavir. Los virus resultantes en el rebote permanecieron sensibles o redujeron levemente la susceptibilidad a amprenavir. Los aislados durante el rebote de dos pacientes sin tratamiento previo con saquinavir continuaron sensibles a este fármaco. Correlación genotípica de sensibilidad fenotípica reducida a lopinavir en virus seleccionados por otros inhibidores de proteasas. Se evaluó la actividad antiviral in vitro de lopinavir contra 112 aislados clínicos obtenidos de pacientes en quienes falló el tratamiento con uno o más inhibidores de proteasas. Las 16 cepas que revelaron un cambio 20 veces mayor en la sensibilidad a lopinavir, contenían mutaciones en las posiciones 10, 54, 63, más 82 y/o 84. Además contenían una mediana de 3 mutaciones en las posiciones 20, 24, 46, 53, 71 y 90. Actividad antiviral de KALETRA en pacientes con tratamiento previo con otro inhibidor de proteasa. La relevancia clínica de la sensibilidad reducida in vitro a lopinavir ha sido examinada evaluando la respuesta virológica al tratamiento con KALETRA, respecto del genotipo y fenotipo viral basal en 56 pacientes con falla previa al tratamiento con varios inhibidores de proteasas y sin tratamiento previo con no nucleósidos (Estudio M98-957). La CE50 de lopinavir contra los 56 aislados virales basales, mostró un rango de 0,5 a 96 veces más alto que la CE50 contra VIH tipo salvaje. Después de 48 semanas de tratamiento con KALETRA, efavirenz y dos inhibidores de transcriptasa inversa nucléosidos, se observó respuesta virológica menor que o igual a 400 copias/ml en 25/27 (93%), 11/15 (73%), y 2/8 (25%), de cepas con sensibilidad basal a lopinavir menor o igual a 10 veces, mayor de 10 y menor de 40 y mayor o igual a 40 veces reducción de susceptibilidad a lopinavir al inicio, respectivamente. El RNA de VIH plasmático menor o igual a 50 copias/ml se observó en 81% (22/27), 60% (9/15) y 25% (2/8) respectivamente en los pacientes mencionados previamente.
Contraindicaciones: KALETRA está contraindicado en pacientes con hipersensibilidad conocida a cualquiera de sus componentes. KALETRA no debe ser coadministrado junto con fármacos cuya depuración es altamente dependiente de CYP3A y cuyas concentraciones plasmáticas elevadas se asocian con eventos graves que amenazan la vida. Estos fármacos se presentan en la Tabla 1.
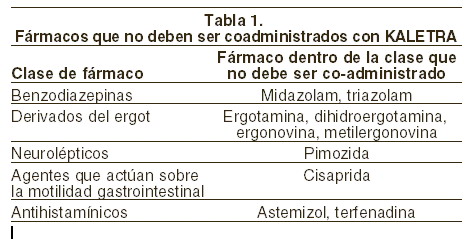
Precauciones generales: KALETRA es un inhibidor de la isoenzima CYP3A, del P-450. La coadministración de KALETRA y fármacos metabolizados principalmente por CYP3A, puede resultar en un incremento en sus concentraciones plasmáticas e incrementar y prolongar sus efectos terapéuticos y adversos (ver Contraindicaciones y Precauciones). Antimicobacterias: KALETRA no debe coadministrarse con rifampicina ya que puede producirse una reducción importante en las concentraciones de lopinavir lo cual puede disminuir significativamente su efecto terapéutico. Corticosteroides: propionato de fluticasona: el uso simultáneo de propionato de fluticasona y KALETRA puede incrementar las concentraciones del propionato de fluticasona. Puede producirse síndrome de Cushing y supresión adrenal cuando se coadministra ritonavir con propionato de fluticasona inhalado o intranasal. Casos similares pueden ocurrir con la coadministración de otros corticosteroides que se metabolizan de manera similar a la fluticasona como es el caso de budesonida. Se debe tener precaución cuando se coadministre KALETRA y cualquier glucocorticoide inhalado o intransal (ver Precauciones). Agentes para la disfunción eréctil: utilice sildenafil, tadalafil o vardenafil con precaución coadministrados con KALETRA ya que los primeros pueden incrementar sus concentraciones que pueden resultar en eventos adversos asociados como hipotensión y erección prolongada (ver Precauciones). Preparaciones herbales: no se recomienda el uso concomitante de KALETRA y la Hierba de San Juan (Hypericum perforatum) o productos que contengan Hierba de San Juan. Se espera que la coadministración de inhibidores de proteasa, incluyendo KALETRA, con la Hierba de San Juan disminuya sustancialmente las concentraciones de inhibidor de proteasa y puede generar niveles subóptimos de KALETRA y conducir a pérdida de respuesta virológica y posible resistencia a KALETRA o a la clase de inhibidores de proteasa (ver Precauciones). Agentes reductores del colesterol: no se recomienda el uso concomitante de KALETRA con lovastatina o simvastatina. Se debe tener precaución si los inhibidores de proteasa del VIH, incluyendo KALETRA, son utilizados concomitantemente con otros inhibidores de la HMG-CoA reductasa, que también son metabolizados por la vía del CYP3A4; por ejemplo, atorvastatina. Se puede incrementar el riesgo de miopatía, incluyendo rabdomiólisis (ver Precauciones). Diabetes mellitus/hiperglucemia: durante la vigilancia posmercadeo en pacientes infectados por VIH que reciben tratamiento con inhibidores de proteasa, se ha informado de diabetes mellitus de inicio reciente, exacerbación de diabetes mellitus preexistente e hiperglucemia. Algunos pacientes requieren inicio o ajuste en las dosis de insulina o hipoglucemiantes orales para el tratamiento de estos eventos. En algunos casos, ha ocurrido cetoacidosis diabética. En aquellos pacientes que suspendieron el tratamiento con inhibidor de proteasa, la hiperglucemia persistió en algunos casos. Como estos eventos han sido informados voluntariamente durante la práctica clínica, no se pueden realizar estimativos de frecuencia y no se ha establecido una relación causal entre el tratamiento con inhibidores de proteasa y estos eventos. Pancreatitis: se han informado casos de pancreatitis en pacientes tratados con KALETRA, incluyendo a aquellos que desarrollaron elevaciones marcadas de triglicéridos. En algunas ocasiones con casos fatales. Si bien no se ha establecido una relación causal con la administración de KALETRA, las elevaciones marcadas de triglicéridos son un factor de riesgo para desarrollo de pancreatitis (ver Precauciones: Elevaciones de los lípidos). Los pacientes con enfermedad avanzada por VIH pueden estar en riesgo aumentado de triglicéridos elevados y pancreatitis, y los pacientes con historia de pancreatitis pueden estar en mayor riesgo de recurrencia durante el tratamiento con KALETRA. Alteraciones hepáticas: KALETRA es metabolizado por el hígado, principalmente, por tanto, se debe tener precaución cuando este medicamento se administre a los pacientes con insuficiencia hepática. KALETRA no ha sido estudiado en pacientes con daño hepático severo. Los datos farmacocinéticos sugieren aumento en las concentraciones plasmáticas de lopinavir en 30%, así como disminución en la unión a proteínas plasmáticas en pacientes con VIH coinfectados con VHC, y leve a moderada insuficiencia hepática. Los pacientes con hepatitis B o C, subyacente, o con marcada elevación de las transaminasas antes del tratamiento pueden estar en mayor riesgo de desarrollar elevación de transaminasas adicional. Han habido informes posmercadeo de disfunción hepática, incluyendo algunas muertes. Estas generalmente han ocurrido en pacientes con enfermedad por VIH avanzada, que toman múltiples medicamentos de manera concomitante, y en casos de hepatitis crónica o cirrosis. No se han establecido una relación causal con el uso de KALETRA. Se debe considerar un incremento en el monitoreo de AST/ALT en esos pacientes, en especial durante los primeros meses de tratamiento con KALETRA. Resistencia/resistencia cruzada: se han observado grados variables de resistencia cruzada entre inhibidores de proteasa. El efecto del tratamiento con KALETRA sobre la eficacia de inhibidores de proteasa administrados subsecuentemente está bajo investigación. Hemofilia: han habido informes de incremento de sangrado, incluyendo hematomas espontáneos en la piel y hermartrosis, en pacientes con hemofilia tipos A y B tratados con inhibidores de proteasa. En algunos pacientes fue administrado factor VIII adicional. En más de la mitad de los casos informados, el tratamiento con inhibidores de proteasa fue continuado o reiniciado. No se ha establecido una relación causal entre el tratamiento con inhibidor de proteasa y estos eventos. Redistribución de grasa: se ha observado redistribución/acumulación de grasa corporal incluyendo obesidad central, aumento de la grasa dorsocervical (joroba de búfalo), adelgazamiento periférico, adelgazamiento facial, aumento de los senos y "apariencia cushingoide" en pacientes que reciben tratamiento antirretroviral. El mecanismo y las consecuencias a largo plazo de estos eventos son desconocidos actualmente. No se ha establecido una relación causal. Elevaciones de los lípidos: el tratamiento con KALETRA ha producido incrementos en la concentración de colesterol total y triglicéridos. La determinación de triglicéridos y colesterol se debe realizar antes de iniciar el tratamiento con KALETRA y a intervalos periódicos durante la terapia. Los trastornos de los lípidos deben ser manejados como es apropiado clínicamente. Ver Precauciones: síndrome de reconstitución inmune: este síndrome se ha reportado en pacientes tratados con terapia antirretroviral combinada incluyendo KALETRA. Durante la fase inicial de la respuesta inmune los pacientes pueden desarrollar una respuesta inflamatoria a infecciones asintomáticas o residuales oportunistas (como infección por Mycobacterium avium, citomegalovirus, neumonía por Pneumocystis jiroveci (antes carinii) o tuberculosis) que puede requerir posterior evaluación y tratamiento.
Restricciones de uso durante el embarazo y la lactancia: Lopinavir en combinación con ritonavir en una relación 2:1, no produjo efecto sobre la fertilidad en ratas con las dosis máximas administradas del medicamento, las cuales fueron comparables o ligeramente menores a las dosis terapéuticas recomendadas. No se observaron malformaciones relacionadas con la administración de KALETRA a conejas o ratas preñadas. La toxicidad sobre el desarrollo se observó en ratas (resorción temprana, viabilidad fetal disminuida, disminución del peso corporal fetal, alteraciones esqueléticas) y con dosificación materna a razón de 100/50 mg/kg/día correspondientes a 0,7 mayor para lopinavir y 1,8 mayor para ritonavir para hombres y mujeres para tratamiento en dosis terapéuticas. No se observó toxicidad sobre desarrollo en conejos con dosificación tóxica materna de aproximadamente 0,6 veces mayor para lopinavir y 1,0 mayor para ritonavir, en relación con la dosis terapéutica recomendada en humanos. No hay estudios adecuados y bien controlados en la mujer embarazada. Como los estudios de reproducción animal no siempre predicen la respuesta humana, KALETRA sólo se debe utilizar durante el embarazo si los beneficios potenciales claramente superan los riesgos. Madres lactantes: en razón del potencial de transmisión del VIH y los posibles efectos adversos, se debe instruir a las madres para que no amamanten a sus hijos si ellas están recibiendo KALETRA. Estudios en ratas han demostrado que lopinavir se secreta en la leche. Se desconoce si lopinavir se secreta en la leche humana.
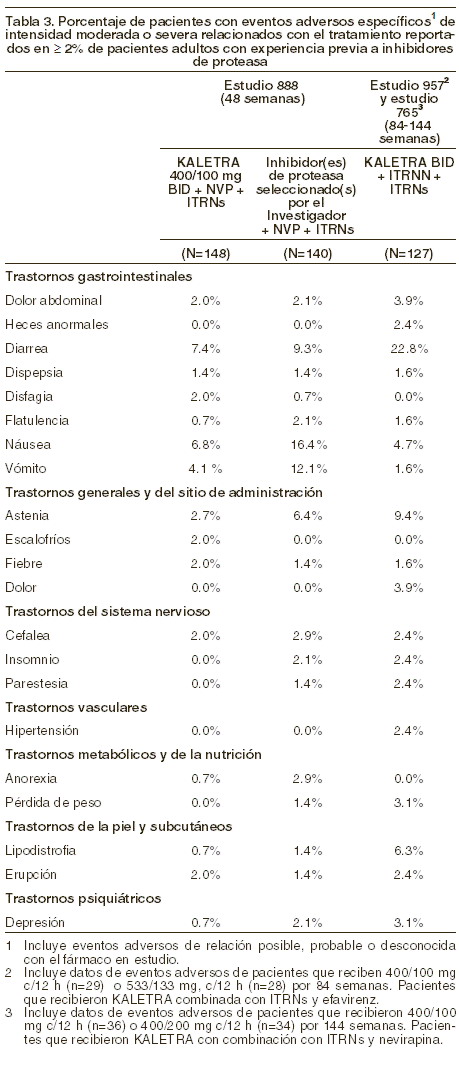
Reacciones secundarias y adversas: KALETRA ha sido estudiado en 891 pacientes como tratamiento de combinación, en estudios clínicos Fase II/III. El evento adverso más común asociado al tratamiento con KALETRA fue diarrea, la cual generalmente fue de severidad leve a moderada. La frecuencia de suspensión del tratamiento, asignado aleatoriamente, debido a eventos adversos incluyendo muerte fue 5,8% en los pacientes tratados con KALETRA y 4,9% en los tratados con nelfinavir en el Estudio M98-863. La medicina incidencia de diarrea fue mayor para KALETRA cápsulas administradas una vez al día comparada con dos veces al día en el estudio 418 (ver tabla 2). Los eventos adversos clínicos, relacionados con el tratamiento, de intensidad moderada a severa en ≥2% de pacientes tratados con terapia de combinación que incluyó KALETRA hasta por 48 semanas y hasta por 360 semanas fase I y II, se presentan en las Tablas 2 y 3.

Infecciones e infestaciones: síndrome gripal, furunculosis, gastroenteritis, infección bacteriana, otitis media, faringitis, sialoadenitis, sinusitis e infección viral. Neoplasias benignas, malignas y no especificadas: quistes, neoplasias y neoplasias benignas de la piel. Alteraciones de los sistemas sanguíneo y linfático: anemia, leucopenia y linfadenopatía. Alteraciones del sistema inmune: reacciones alérgicas. Alteraciones endocrinas: síndrome de Cushing e hipotiroidismo. Alteraciones metabólicas y nutricionales: avitaminosis, deshidratación, diabetes mellitus, aumento del apetito, acidosis láctica, obesidad y ganancia de peso. Alteraciones psiquiátricas: sueños anormales, agitación, ansiedad, apatía, confusión, labilidad emocional, nerviosismo e ideas anormales. Alteraciones del sistema nervioso: amnesia, ataxia, infarto cerebral, crisis convulsivas, vértigo, discinesia, encefalopatía, síndrome extrapiramidal, parálisis facial, hipertonía, migraña, neuropatía, neuritis periférica, somnolencia, pérdida del gusto, alteraciones del gusto y temblor. Alteraciones oculares: visión anormal y alteraciones de los ojos. Alteraciones auditivas y del laberinto: zumbidos y vértigo. Alteraciones cardíacas: fibrilación auricular, infarto al miocardio y palpitaciones. Alteraciones vasculares: trombosis venosa profunda, hipotensión postural, tromboflebitis, venas varicosas y vasculitis. Alteraciones respiratorias, torácicas y mediastinales: asma, tos incrementada, disnea, edema pulmonar y rinitis. Alteraciones gastrointestinales: constipación, boca seca, enteritis, enterocolitis, eructos, esofagitis, incontinencia fecal, gastritis, colitis hemorrágica, ulceración bucal, pancreatitis, periodontitis, estomatitis y estomatitis ulcerosa. Alteraciones hepatobiliares: colangitis, colecistitis, hepatitis, hepatomegalia, ictericia, depósitos grasos hepáticos e hipersensibilidad hepática. Alteraciones de piel y tejidos blandos: acné, alopecia, piel reseca, eccema, dermatitis exfoliativa, edema facial, erupción maculopapular, alteraciones ungueales, prurito, seborrea, decoloración cutánea, ulceras cutáneas, estrías cutáneas y sudoración. Alteraciones musculoesqueléticas y del tejido conectivo: artralgias, artrosis, dolor lumbar, necrosis ósea, alteraciones articulares y miastenia. Alteraciones renales y urinarias: cálculos renales, nefritis y anormalidades urinarias. Alteraciones del sistema reproductivo: eyaculación anormal, crecimiento mamario, ginecomastia e impotencia. Alteraciones generales y condiciones del sitio de administración: dolor torácico, dolor torácico subesternal, interacciones farmacológicas, edema, hipertrofia, malestar general y edema periférico. Investigaciones: aumento del nivel del fármaco y disminución de la tolerancia a la glucosa. Experiencia postregistro: en pacientes bajo tratamiento con KALETRA se ha reportado hepatitis, síndrome de Stevens-Johnson, eritema multiforme y bradiarritmia.
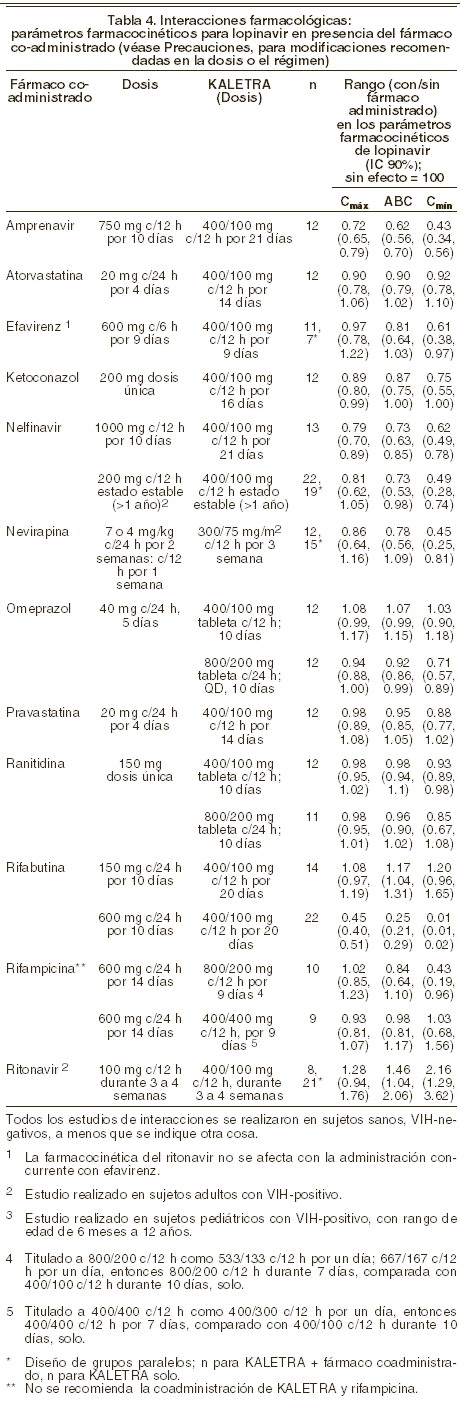
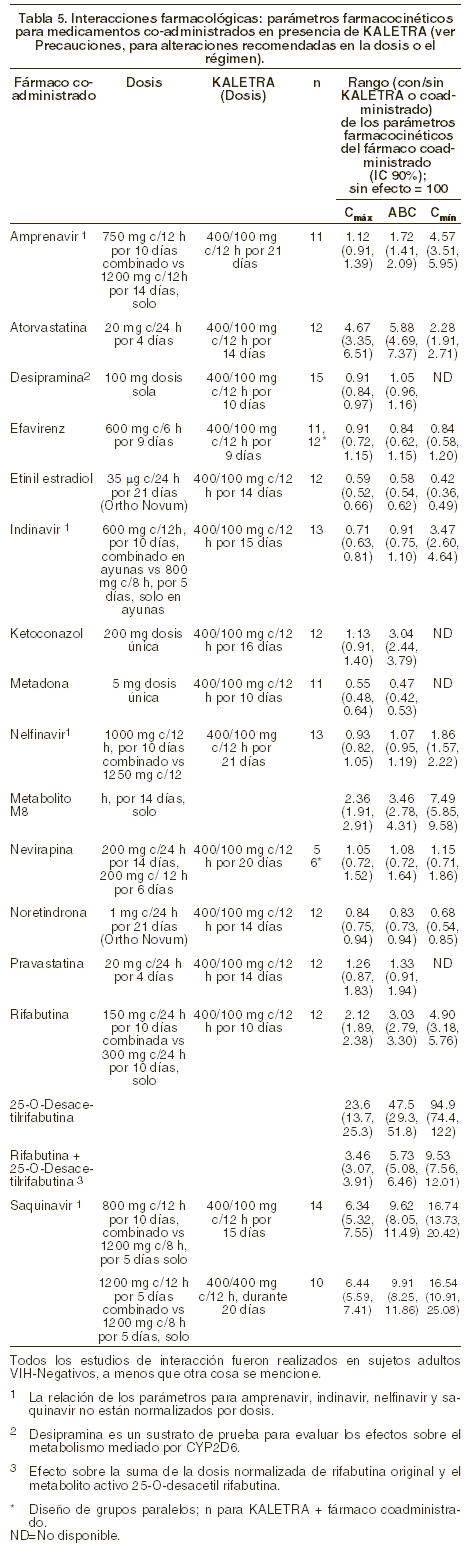
Interacciones medicamentosas y de otro género: KALETRA es un inhibidor de CYP3A (citocromo P-450) in vivo e in vitro. La coadministración de KALETRA y fármacos metabolizados principalmente por CYP3A (por ejemplo bloqueadores de los canales de calcio, inhibidores de HMG-CoA reductasa, inmunosupresores y sildenafil) puede resultar en concentraciones plasmáticas incrementadas de los otros fármacos que puedan aumentar o prolongar su efecto terapéutico y efectos indeseables (ver Precauciones). Los medicamentos contraindicados específicamente debido a la magnitud esperada de interacción y potencial para eventos serios indeseables se listan en la Tabla 1 en el segmento de Contraindicaciones. KALETRA es metabolizado por el CYP3A. La coadministración de lopinavir/ritonavir y los fármacos que inducen el CYP3A puede disminuir las concentraciones plasmáticas de lopinavir y reducir sus efectos terapéuticos. Aunque no se ha observado con la administración concomitante de ketoconazol, la coadministración de lopinavir/ritonavir y otros fármacos que inhiben el CYP3A puede incrementar las concentraciones plasmáticas de lopinavir. Agentes anti-VIH: inhibidores de la transcriptasa inversa nucleósidos - nucléotidos (ITRN): estavudina y lamivudina: no se observó ningún cambio en la farmacocinética de lopinavir cuando KALETRA fue administrado solo o en combinación con estavudina y lamivudina. Didanosina: se recomienda que didanosina se administre con el estómago vacío; por lo tanto, didanosina se debe administrar una hora antes o dos horas después de KALETRA (administrar con los alimentos). Zidovudina y abacavir: KALETRA induce glucuronidación, por lo tanto tiene el potencial de reducir las concentraciones plasmáticas de zidovudina y abacavir. Se desconoce el significado clínico de esta potencial interacción. Tenofovir: KALETRA incrementa las concentraciones de tenofovir por mecanismos aún no conocidos. Su uso simultáneo debe vigilarse por los posibles eventos adversos. Todos: se ha reportado incremento en CPK, mialgia, miositis y rabdomiólisis raramente con el uso de IPs, particularmente en combinación con ITRN. Inhibidores de la transcriptasa inversa no nucleósidos (ITRNN): nevirapina: cuando KALETRA se administró con nevirapina en estudios clínicos pediátricos se observa que las concentraciones de lopinavir podrían verse disminuidas. Se espera la misma observación en pacientes adultos. En pacientes con experiencia previa a antirretrovirales y evidencia fenotípica o genotípica de disminución de sensibilidad de KALETRA, se debe considerar un incremento de dosis de KALETRA a 533/133 mg cada 12 horas. KALETRA no debe administrarse una vez al día en combinación con nevirapina. Efavirenz: cuando se utilizó en combinación con efavirenz y dos nucleósidos inhibidores de la transcriptasa inversa, en pacientes que habían experimentado múltiples inhibidores de proteasa, el incremento en la dosis de KALETRA de 33,3%, desde 400/100 mg (3 cápsulas) cada 12 horas hasta 533/133 mg (4 cápsulas) cada 12 horas, produjo concentraciones plasmáticas similares de lopinavir en comparación con datos históricos de lopinavir/ritonavir 400/100, cada 12 horas. En pacientes con experiencia previa a IPs o evidencia fenotípica o genotípica de disminución de sensibilidad a lopinavir, el incremento de dosis a 533/133 mg c/12 h de KALETRA debe considerarse cuando se coadministra efavirenz. Nota: efavirenz y nevirapina inducen la actividad del CYP3A y por lo tanto tiene el potencial de disminuir las concentraciones plasmáticas de otros inhibidores de proteasa cuando se usan en combinación con KALETRA. KALETRA no debe administrarse una vez al día en combinación en efavirenz. Delavirdina: delavirdina tiene el potencial de incrementar las concentraciones plasmáticas de lopinavir. Inhibidores de proteasa (IPs): amprenavir: KALETRA incrementa las concentraciones de amprenavir. La coadministración de KALETRA y amprenavir da como resultado una disminución en las concentraciones de lopinavir. La dosis de KALETRA podría requerir un incremento durante la coadministración con amprenavir. KALETRA no debe administrarse una vez al día en combinación con amprenavir. Fosamprenavir: su coadministración con KALETRA disminuye las concentraciones de lopinavir y amprenavir. Las dosis apropiadas en la combinación con respecto a seguridad y eficacia no han sido establecidas. Indinavir: KALETRA incrementa las concentraciones de indinavir. La dosis de indinavir podría requerir una disminución durante la coadministración con KALETRA. KALETRA una vez al día no se ha estudiado en combinación con indinavir. Nelfinavir: KALETRA incrementa las concentraciones de nelfinavir y el metabolito activo M8. La coadministración con KALETRA reduce las concentraciones de lopinavir. Puede ser necesario incrementar la dosis de KALETRA cuando se coadministra con nelfinavir, particularmente en pacientes pretratados o con susceptibilidad reducida a lopinavir. Ritonavir: cuando KALETRA se coadministró con ritonavir adicional 100 dos veces al día, el ABC de lopinavir se incrementó 33% y Cmín se incrementó 64%, en comparación con lopinavir/ritonavir 400/100 mg (tres cápsulas de gelatina blanda) cada 12 horas. Saquinavir: KALETRA incrementa las concentraciones de saquinavir. Puede ser necesario ajustar la dosis de saquinavir cuando se coadministra con KALETRA 400/100 mg c/12 h. KALETRA una vez al día no ha sido estudiado en combinación con saquinavir. Tipranavir: en un estudio de doble IP reforzado en pacientes adultos pretratados, tipranavir 500 mg con ritonavir 200 mg c/12 horas coadministrados con KALETRA (400/100 mg c/12 horas) mostró una reducción del 47% y 70% en el ABC y Cmín de lopinavir respectivamente, por lo que el uso simultáneo de KALETRA y tipranavir con dosis bajas de ritonavir no se recomienda. Otros fármacos: antiarrítmicos: las concentraciones de amiodarona, bepridil, lidocaína (sistémica) y quinidina se pueden incrementar cuando se coadministran con KALETRA. Se debe tener precaución y se recomienda monitorizar las concentraciones terapéuticas cuando sea factible. Digoxina: la coadministración de ritonavir (300 mg c/12 h) y digoxina muestra una elevación significativa de los niveles de digoxina de acuerdo con un reporte de la literatura. Se debe tener precaución cuando se administre KALETRA con digoxina a través de un monitoreo adecuado de los niveles de digoxina. Anticoagulantes: las concentraciones de warfarina se pueden afectar cuando se coadministra con KALETRA. Se recomienda monitorizar el INR (International Normalized Ratio). Antidepresivos: trazodona: sus niveles pueden elevarse con el uso simultáneo de ritonavir. Se han observado náusea, mareo, hipotensión y síncope como efectos secundarios. Su uso simultáneo con KALETRA debe ser usado con precaución considerando dosis menores de trazodona. Anticonvulsivantes: carbamazepina, fenobarbital y fenitoína son inductores del CYP3A4 y pueden disminuir las concentraciones plasmáticas de lopinavir. KALETRA no debe administrarse una vez al día con fenobarbital, fenitoína o carbamazepina. Antimicóticos: ketoconazol e itraconazol pueden elevar sus concentraciones cuando se coadministran con KALETRA. No se recomiendan dosis altas de de ketoconazol e itraconazol (mayores de 200 mg/día). Voriconazol: la coadministración con ritonavir 400 mg c/12 h disminuye el ABC de voriconazol en promedio 82% de acuerdo con un reporte, por lo tanto la administración simultanea con KALETRA no se recomienda. Antiinfecciosos: se esperan moderados incrementos en el ABC de claritromicina cuando se coadministran con KALETRA. En pacientes con alteraciones renales o hepáticas se debe reducir la dosis de claritromicina. Antimicobacterianos: se recomienda que se reduzca la dosis de rifabutina 75% (150 mg cada tercer día o tres veces por semana) cuando se coadministra con KALETRA por el incremento notable en las concentraciones de la primera. El uso de rifampicina con KALETRA puede llevar a pérdida de la respuesta virológica y posible resistencia a KALETRA, o la clase de inhibidores de proteasa u otros agentes antirretrovirales coadministrados. Un estudio evaluó la combinación de rifampicina 600 mg, cada 24 horas con KALETRA 800/200 mg, cada 12 horas o KALETRA 400/100 mg más ritonavir 300 mg, cada 12 horas. Los resultados farmacocinéticos y de seguridad, no permiten la recomendación de dosis. Nueve sujetos (28%) tuvieron ≥ grado 2 de aumento en ALT/AST, de los cuales siete (21%) suspendieron el estudio prematuramente. Con base en el diseño del estudio, no es posible determinar si la frecuencia o la magnitud de la elevación de ALT/AST observadas son mayores que las que pudieran ser vistas con rifampicina sola. Antiparasitarios: pueden ser necesarios incrementos en la dosis de atovacuona dada la disminución de las concentraciones de esta en coadmiistración con KALETRA. Corticoesteroides: dexametasona puede inducir la CYP3A4 y puede disminuir las concentraciones plasmáticas de lopinavir. Propionato de fluticasona: su uso simultáneo con KALETRA puede incrementar las concentraciones del propionato de fluticasona. Utilícese con precaución. Considere alternativas para el propionato de fluticasona, especialmente para su uso a largo plazo (ver Precauciones). Bloqueadores de los canales de calcio: los agentes dihidropiridínicos (por ejemplo, felodipina, nifedipina, nicardipina) pueden aumentar sus concentraciones cuando se coadministran con KALETRA. Disulfiram/metronidazol: la solución oral de KALETRA contiene alcohol, que puede producir reacciones parecidas al disulfiram cuando se coadministra con este agente u otros que producen esta reacción como el metronidazol. Agentes para la disfunción eréctil: sildenafil: utilice este medicamento con precaución a dosis reducidas de 25 mg c/48 h con estrecha vigilancia de eventos adversos (ver Precauciones). Tadalafil: utilícese con precaución a dosis reducidas de no más de 10 mg c/72 h con estrecha vigilancia para eventos adversos (ver Precauciones). Vardenafil: úsese con precaución a dosis reducidas de no más de 2,5 mg c/72 h con vigilancia estrecha para eventos adversos (ver Precauciones). Preparaciones herbales: la Hierba de San Juan (Hypericum perforatum) o los productos que contienen Hierba de San Juan pueden disminuir sustancialmente las concentraciones de KALETRA, por inducir al CYP3A4 resultando en una pérdida del efecto terapéutico y eventual resistencia, por lo que no deben coadministrarse (ver Precauciones). Agentes reductores del colesterol: se espera que se incrementen de manera marcada las concentraciones de lovastatina y simvastatina cuando se coadministran con KALETRA con posibilidad de ocasionar miopatía y/o rabdomiólisis por lo que la coadministración con KALETRA no se recomienda (ver Precauciones). Atorvastatina es menos dependiente de la influencia metabólica de CYP3A y sus concentraciones también se incrementan, por lo que debe administrarse la dosis más baja posible con el uso simultáneo con KALETRA. Los estudios farmacológicos no revelan interacciones clínicamente significativas entre KALETRA, pravastatina y fluvastatina, por lo que se recomiendan cuando se requiere coadministrar un inhibidor de HMG-CoA (ver Precauciones). Inmunosupresores: las concentraciones de ciclosporina, tacrolimus y sirolimus (rapamicina) pueden incrementarse cuando se coadministran con KALETRA. Se recomienda el monitoreo de la concentración terapéutica. Metadona: KALETRA disminuye los niveles plasmáticos de metadona por lo que se recomienda el monitoreo de las concentraciones plasmáticas de este medicamento. Contraceptivos orales o en parche: se deben utilizar medidas adicionales de contracepción ante la disminución de los niveles de etinilestradiol en ambas presentaciones cuando se coadministran con KALETRA. Interacciones farmacológicas clínicamente significativas no esperadas: con base a los perfiles metabólicos conocidos, no se esperan interacciones farmacológicas clínicamente significativas entre KALETRA, fluvastatina, dapsona, trimetoprim/sulfametoxazol, azitromicina, o fluconazol en pacientes con función hepática y renal normales. Estudios de interacción farmacológica no revelaron interacciones clínicamente significativas entre desipramina, omeprazol o ranitidina. Los efectos de la coadministración de KALETRA con otros fármacos están resumidos en la Tabla 4 (efecto de otros fármacos sobre lopinavir) y la Tabla 5 (efecto de lopinavir sobre otros fármacos). No se presentan los efectos de otros fármacos sobre ritonavir ya que ellos generalmente se correlacionan con los observados con lopinavir (si las concentraciones de lopinavir están disminuidas, las concentraciones de ritonavir están disminuidas) a menos que se indique de otro modo en las notas al pie de las tablas. Para información con respecto a recomendaciones clínicas, ver Precauciones.
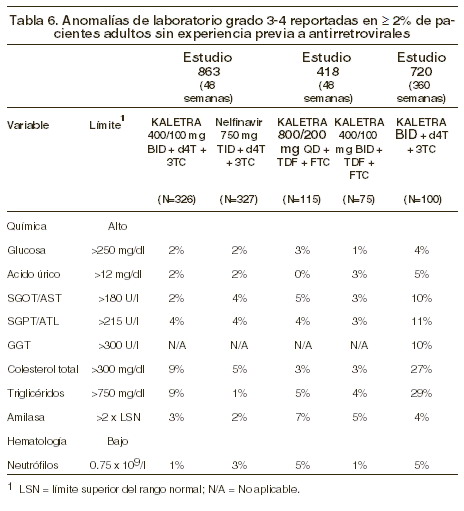
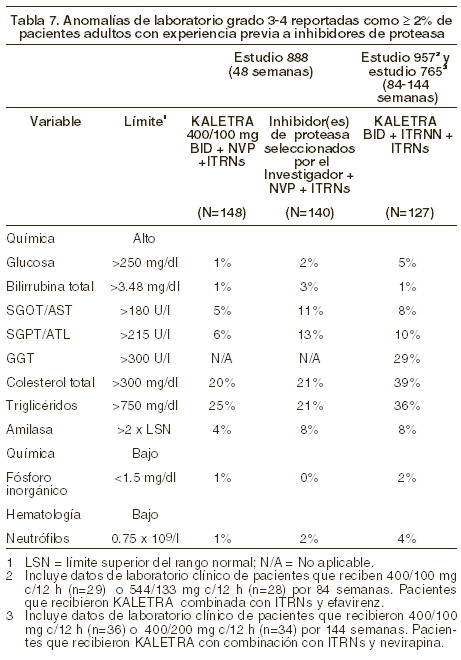
Alteraciones en los resultados de pruebas de laboratorio: Los porcentajes de pacientes tratados con terapia combinada (lopinavir/ritonavir) que presentaron alteraciones de laboratorio de grado 3 a 4, se presentan en las Tablas 6, 7 y 8.

Precauciones en relación con efectos de carcinogénesis, mutagénesis, teratogénesis y sobre la fertilidad: Carcinogénesis y mutagénesis: los estudios de carcinogenicidad a largo plazo con KALETRA en ratones mostraron poca relevancia para riesgo en humanos. No se encontró que lopinavir fuera mutagénico o clastogénico en una serie de ensayos in
vitro, incluyendo la evaluación de mutación inversa bacteriana de Ames, el ensayo de linfoma en ratón, y la evaluación de aberración cromosómica en linfocitos humanos. KALETRA no mostró ser mutagénico o clastogénico en ensayos in vivo utilizando el ensayo de micronúcleos en el ratón.
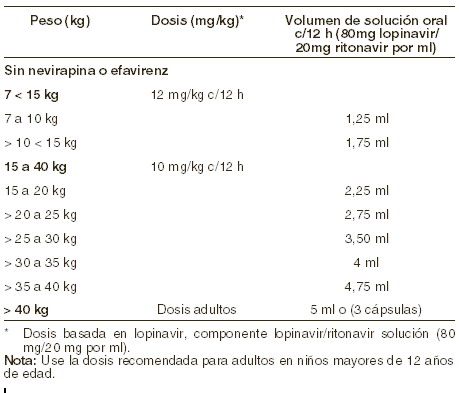
Dosis y vía de administración: Adultos: KALETRA en cápsulas y solución oral debe ser tomada con los alimentos. La dosis oral de KALETRA se recomienda como sigue: pacientes sin experiencia previa a tratamiento: KALETRA 400/100 mg (3 cápsulas o 5 ml) dos veces al día con los alimentos. KALETRA 800/200 mg (6 cápsulas o 10 ml) una vez al día con los alimentos. Pacientes con experiencia previa a tratamiento: KALETRA 400/100 mg (3 cápsulas o 5 ml) dos veces al día tomado con los alimentos. El uso de KALETRA una vez al día no ha sido estudiado en pacientes con experiencia previa a tratamiento. Tratamiento concomitante: omeprazol y ranitidina: KALETRA cápsulas y solución oral pueden utilizarse en combinación con fármacos reductores de ácido gástrico (omeprazol y ranitidina) sin requerir ajuste de dosis. Efavirenz, nevirapina, amprenavir, fosamprenavir o nelfinavir. Se sugiere considerar un incremento de dosis de KALETRA de 533/133 mg (cuatro) cápsulas de gel blando o 6,5 ml c/12 hrs con alimentos, cuando se utilice en combinacion con efavirenz o nevirapina en pacientes con experiencia previa a tratamiento en los que se sospeche de susceptibilidad reducida a lopinavir (por historia de tratamiento o evidencia de laboratorio) (ver Interacciones medicamentosas). KALETRA no debe administrarse en esquema de una vez al día en combinación con efavirenz, nevirapina, amprenavir o nelfinavir. Pacientes pediátricos: en niños de 6 meses a 12 años de edad, la dosis recomendada de KALETRA solución oral es 12/3 mg/kg para los pacientes de 7 a menos de 15 kg y 10/2,5 mg/kg para un peso de 15 a 40 kg (aproximadamente el equivalente de 230/57,5 mg/m2); dos veces al día tomado con los alimentos, hasta una dosis máxima de 400/100 mg en niños de más de 40 kg (5 ml o 3 cápsulas) dos veces al día. KALETRA administrado una vez al día no ha sido evaluado en pacientes pediátricos. Se prefiere que el médico tratante calcule la dosis apropiada en miligramos para cada paciente de 12 años o menor y determine el volumen correspondiente de solución o el número de cápsulas, sin embargo como alternativa, la tabla a continuación contiene una guía de dosificación de KALETRA en solución con base en el peso corporal.
Manifestaciones y manejo de la sobredosificación o ingesta accidental: La experiencia humana con sobredosis aguda con KALETRA es limitada. El tratamiento de la sobredosis con KALETRA debe consistir en medidas generales de soporte que incluyan monitoreo de los signos vitales y observación del estado clínico del paciente. No hay antídoto específico para sobredosis con KALETRA. Si está indicado, se puede obtener la eliminación del fármaco no absorbido mediante emesis o lavado gástrico. También puede utilizarse la administración de carbón activado para ayudar a remover el fármaco no absorbido. Como KALETRA tiene alta unión a las proteínas, la diálisis probablemente no es benéfica para la eliminación significativa del medicamento. KALETRA solución oral contiene 42,4% (v/v) de alcohol. La ingestión accidental del producto por niños pequeños puede resultar en toxicidad significativa por alcohol.
Presentación(es): KALETRA (lopinavir/ritonavir) cápsulas de gelatina blanda. La cápsula contiene 133,3 mg de lopinavir/33,3 mg de ritonavir en presentación de frascos con 180 cápsulas, cada uno. KALETRA (lopinavir/ritonavir) se presenta en frasco color ámbar de dosis múltiples de 160 ml con un vasito dosificador graduado.
Recomendaciones sobre almacenamiento: Las cápsulas de gelatina blanda se almacenan entre 2°C - 8°C hasta que sean entregadas al paciente. No se requiere refrigeración si son utilizadas dentro de los siguientes 42 días y almacenadas por debajo de 25°C. Almacenar KALETRA solución entre 2°C - 8°C hasta que sea entregada al paciente. No se requiere refrigeración si se utiliza dentro de los siguientes 42 días y se almacena por debajo de 25°C. Evitar la exposición al calor excesivo.
Leyendas de protección: Su venta requiere receta médica. No se deje al alcance de los niños.
Nombre y domicilio del laboratorio: Cápsulas. Hecho por: Cardinal Health 2725 Scherer Drive, St. Petersburg, Florida, 33716-1016, EUA. Para: Abbott Laboratories. North Chicago, Il 60064, EUA. Acondicionado y distribuido por: ABBOTT LABORATORIES DE MEXICO, S.A. de C.V., Av. Coyoacán 1622, Col. Del Valle, 03100, México, D.F. Solución. Hecho por: Abbott Laboratorios. North Chicago, Il 60064 EUA. Acondicionado y distribuido por: ABBOTT LABORATORIES DE MEXICO, S.A. de C.V., Av. Coyoacán 1622, Col. Del Valle, 03100, México, D.F.
Número de registro del medicamento: Cápsulas: 497M2000 SSA IV. Solución: 556M2000 SSA IV.
Clave de IPPA: Cápsulas: JEAR-05330020510433/RM2005. Solución: AEAR-06350122070110/RM2007.
KALETRA
ABBVIE
Tabletas recubiertas
Denominación genérica: Lopinavir/ritonavir.
Forma farmacéutica y formulación: Tabletas recubiertas. Cada tableta contiene: lopinavir 200 mg, ritonavir 50 mg. Excipientes cbp 1 tableta.
Indicaciones terapéuticas: KALETRA está indicado en combinación con otros agentes antirretrovirales para el tratamiento de la infección por VIH. Esta indicación se basa en el análisis de los niveles plasmáticos del ARN del VIH y los conteos de células CD4+ en un estudio controlado con lopinavir/ritonavir, de 48 semanas de duración, y en estudios adicionales con KALETRA, de 360 semanas de duración. Aún no se tienen resultados de estudios que evalúan el efecto de KALETRA sobre la progresión del VIH. La administración de KALETRA una vez al día no ha sido estudiada en pacientes con experiencia previa a antirretrovirales.
Farmacocinética y farmacodinamia: Farmacocinética: las propiedades farmacocinéticas de lopinavir coadministrado con ritonavir han sido evaluadas en voluntarios adultos sanos y en pacientes infectados con VIH; no se observaron diferencias sustanciales entre los dos grupos. Lopinavir se metaboliza por completo esencialmente por el CYP3A. Ritonavir inhibe el metabolismo de lopinavir; por tanto, incrementa los niveles plasmáticos de lopinavir. A través de los estudios, la administración de KALETRA 400/100 mg, dos veces al día, produjo concentraciones plasmáticas promedio de lopinavir, en estado de equilibrio, 15 a 20 veces más altas que las de ritonavir en pacientes infectados por VIH. Los niveles plasmáticos de ritonavir son menos del 7% de aquellos obtenidos después de una dosis de ritonavir de 600 mg, dos veces al día. La CE50 antiviral de lopinavir in vitro es aproximadamente 10 veces más baja que la de ritonavir. Por tanto, la actividad antiviral de KALETRA se debe a lopinavir. Absorción: en un estudio farmacocinético en sujetos VIH-positivos (n=19), sin restricción en la dieta, la dosificación múltiple con KALETRA 400/100 mg, cada 12 horas, durante 3 semanas, produjo una concentración plasmática máxima promedio ± DE de lopinavir (Cmáx) de 9,8 ± 3,7 mg/ml después de 4 hs. El ABC de lopinavir, durante un intervalo de dosificación de 12 horas, tuvo un promedio de 92,6 ± 36,7 mg•h/ml. No se ha establecido la biodisponibilidad absoluta de lopinavir coformulado con ritonavir, en humanos. Efectos de los alimentos sobre la absorción oral: la administración de KALETRA tabletas en dosis única de 400/100 mg bajo condiciones de alimentación (alta en grasas, 872 kcal, 56% de grasa) comparado con ayuno, no se asoció con cambios significativos en Cmáx y ABCinf, por lo tanto las tabletas de KALETRA se pueden tomar con o sin alimentos. Las tabletas de KALETRA también mostraron menos variabilidad farmacocinética en todas las condiciones de alimentación en comparación con KALETRA cápsulas. Distribución: en estado de equilibrio, lopinavir se une aproximadamente en un 98 a 99% a las proteínas séricas; la proteína de unión de alta afinidad es la glucoproteína alfa-1-ácida (AAG) y albúmina. En estado de equilibrio, la unión de lopinavir a las proteínas permanece constante en el rango de concentraciones observadas después de 400/100 mg de KALETRA, dos veces al día, y es similar entre sujetos sanos y VIH-positivos. Metabolismo: experimentos in vitro con microsomas hepáticos humanos indican que lopinavir sufre metabolismo hepático oxidativo, principalmente por el sistema del citocromo P-450, casi exclusivamente por la isoenzima CYP3A. Ritonavir es un potente inhibidor del CYP3A, entonces inhibe el metabolismo de lopinavir e incrementa sus niveles plasmáticos. Un estudio con lopinavir marcado con 14C en humanos mostró que el 89% de la radioactividad en plasma, después de una dosis única de 400/100 mg de KALETRA, fue debida al fármaco original. En el hombre se han identificado por lo menos 13 metabolitos oxidativos de lopinavir. Ritonavir ha mostrado inducir las enzimas metabólicas, lo que resulta en la inducción de su propio metabolismo. Las concentraciones pre-dosis de lopinavir declinan con el tiempo durante la dosificación múltiple, y se estabilizan aproximadamente después de 10 a 16 días. Eliminación: después de una dosis de 400/100 mg de 14C-lopinavir/ritonavir, aproximadamente el 10,4 ± 2,3% y el 82,6 ± 2,5% se puede encontrar en la orina y las heces, respectivamente después de 8 días. Lopinavir sin cambios corresponde a 2,2% y 19,8% en la orina y las heces, respectivamente. Después de dosificación múltiple, menos del 3% de la dosis de lopinavir se excreta sin cambios en la orina. La depuración aparente de lopinavir oral es de 5,98 ± 5,75 l/h (promedio ± DE, n=19). Dosificación una vez al día: la farmacocinética de KALETRA una vez al día se evaluó en pacientes VIH+ sin tratamiento antirretroviral previo. KALETRA 800/200 mg se administró en combinación con emtricitabina 200 mg y tenofovir DF 300 mg como parte del tratamiento diario. Seis horas después de la administración de KALETRA 800/200 mg una vez al día en dosis múltiples con alimentos por 4 semanas, se produjo una concentración plasmática máxima (Cmáx) en promedio ± DE de lopinavir de 11,8 ± 3,7 mg/ml 6 horas después de la administración. La concentración valle de lopinavir promedio en estado estable previo a la dosis matutina fue de 3,2 ± 2,1 mg/ml y la concentración mínima dentro del intervalo de dosificación fue de 1,7 ± 1,6 mg/ml. El área bajo la curava de lopinavir en un intervalo de dosificación de 24 h promedió 154,1 ± 61,4 mg•h/ml. Poblaciones especiales: sexo, raza y edad: no se ha estudiado la farmacocinética de lopinavir en pacientes ancianos. No se han observado diferencias farmacocinéticas relacionadas con la edad o el sexo en pacientes adultos. No se han identificado diferencias farmacocinéticas debidas a la raza. Pacientes pediátricos: la farmacocinética de KALETRA ha sido estudiada en un total de 53 pacientes pediátricos, con rango de edad entre 6 meses a 12 años. El esquema de 230/57,5 mg/m2 c/12 h sin nevirapina y el esquema de 300/75 mg/m2 c/12 h con nevirapina mostró concentraciones de lopinavir en plasma similares a las obtenidas en pacientes adultos que recibieron un esquema de 400/100 mg c/12 h (sin nevirapina). KALETRA en dosis una vez al día no ha sido estudiado en pacientes pediátricos. Insuficiencia renal: no se ha estudiado la farmacocinética de KALETRA en pacientes con insuficiencia renal; sin embargo, ya que la depuración renal de lopinavir es mínima, no se espera una disminución en la depuración corporal total en pacientes con insuficiencia renal. Insuficiencia hepática: lopinavir se metaboliza y elimina principalmente por el hígado. La dosificación múltiple de KALETRA 400/100 mg dos veces al día a pacientes VIH y VHC coinfectados, con insuficiencia hepática leve a moderada, ocasionó un aumento de 30% en el ABC del lopinavir y 20% de aumento en la Cmáx, comparada con sujetos infectados por VIH y con función hepática normal. Además, la unión a las proteínas plasmáticas de lopinavir fue menor en caso de insuficiencia hepática leve y moderada, comparado con los controles (99,09 vs. 99,31%, respectivamente). KALETRA no se ha estudiado en pacientes con insuficiencia hepática severa (ver Precauciones). Farmacodinamia: microbiología: mecanismo de acción: lopinavir es un inhibidor de las proteasas del VIH-1 y VIH-2. La inhibición de la proteasa del VIH impide la división de la poliproteína gag-pol, lo que genera la producción de virus inmaduros, no infecciosos. Actividad antiviral in vitro: la actividad antiviral de lopinavir in vitro contra cepas clínicas de VIH de laboratorio fue evaluada en líneas celulares linfoblásticas infectadas agudamente y linfocitos de sangre periférica, respectivamente. En ausencia de suero humano, la CE50 promedio de lopinavir contra cinco cepas diferentes de laboratorio de VIH-1 y una VIH-2 fue de 10 a 27 nM (0,006 a 0,017 mg/ml, 1mg/ml igual a 1,6 mcM) y en rango de de 4 a 11 nM (0,003 a 0,007 mg/ml). En presencia de suero humano al 50%, las CE50 promedio de lopinavir contra estas cinco cepas de laboratorio oscilaron de 65 a 289 nM (0,04 a 0,18 mg/ml). Los estudios de actividad de combinación de medicamentos con lopinavir y otros inhibidores de la proteasa o inhibidores de la transcriptasa inversa no se han completado aún. Resistencia: han sido seleccionados aislados de VIH-1 in vitro, con sensibilidad reducida a lopinavir. La presencia de ritonavir no parece influir en la selección de virus resistentes a lopinavir in vitro. La selección de resistencia a KALETRA en pacientes sin experiencia previa a antirretrovirales no se ha identificado. Se ha observado resistencia a KALETRA en pacientes tratados con otros inhibidores de proteasa previos. La selección de resistencia a KALETRA en el tratamiento de pacientes pediátricos sin tratamiento previo parece ser consistente con la de los adultos. No existen aun datos suficientes que permitan identificar patrones de mutaciones a lopinavir en pacientes bajo tratamiento con KALETRA. La evaluación de este patrón de mutaciones está siendo estudiada. Resistencia cruzada: se dispone de poca información sobre resistencia cruzada de virus seleccionados durante el tratamiento con KALETRA. En cuatro pacientes previamente tratados con uno o más inhibidores de proteasa que desarrollaron resistencia fenotípica a lopinavir durante la terapia con KALETRA permanecieron con resistencia cruzada o la desarrollaron a ritonavir, indinavir y nelfinavir. Los virus resultantes en el rebote permanecieron sensibles o redujeron levemente la susceptibilidad a amprenavir. Los aislados durante el rebote de dos pacientes sin tratamiento previo con saquinavir continuaron sensibles a este fármaco. Correlación genotípica de sensibilidad fenotípica reducida a lopinavir en virus seleccionados por otros inhibidores de proteasas: se evaluó la actividad antiviral in vitro de lopinavir contra 112 aislados clínicos obtenidos de pacientes en quienes falló el tratamiento con uno o más inhibidores de proteasas. Las 16 cepas que revelaron un cambio 20 veces mayor en la sensibilidad a lopinavir, contenían mutaciones en las posiciones 10, 54, 63, más 82 y/o 84. Además contenían una mediana de 3 mutaciones en las posiciones 20, 24, 46, 53, 71 y 90. Actividad antiviral de KALETRA en pacientes con tratamiento previo con otro inhibidor de proteasa. La relevancia clínica de la sensibilidad reducida in vitro a lopinavir ha sido examinada evaluando la respuesta virológica al tratamiento con KALETRA, respecto del genotipo y fenotipo viral basal en 56 pacientes con falla previa al tratamiento con varios inhibidores de proteasa y sin tratamiento previo con no nucleósidos (Estudio M98-957). La CE50 de lopinavir contra los 56 aislados virales basales, mostró un rango de 0,5 a 96 veces más alto que la CE50 contra VIH tipo salvaje. Después de 48 semanas de tratamiento con KALETRA, efavirenz y dos inhibidores de transcriptasa inversa nucléosidos, se observó respuesta virológica menor que o igual a 400 copias/ml en 25/27 (93%), 11/15 (73%), y 2/8 (25%), de cepas con sensibilidad basal a lopinavir menor o igual a 10 veces, mayor de 10 y menor de 40 y mayor o igual a 40 veces reducción de susceptibilidad a lopinavir al inicio, respectivamente. El RNA de VIH plasmático menor o igual a 50 copias/ml se observó en 81% (22/27), 60% (9/15) y 25% (2/8) respectivamente en los pacientes mencionados previamente.
Contraindicaciones: KALETRA está contraindicado en pacientes con hipersensibilidad conocida a cualquiera de sus componentes. KALETRA no debe ser coadministrado junto con fármacos cuya depuración es altamente dependiente de CYP3A y cuyas concentraciones plasmáticas elevadas se asocian con eventos graves que amenazan la vida. Estos fármacos se presentan en la Tabla 1.

Precauciones generales: KALETRA es un inhibidor de la isoenzima CYP3A, del P-450. La coadministración de KALETRA y fármacos metabolizados principalmente por CYP3A, puede resultar en un incremento en sus concentraciones plasmáticas e incrementar y prolongar sus efectos terapéuticos y adversos (ver Contraindicaciones y Precauciones). Antimicobacterias: KALETRA no debe coadministrarse con rifampicina ya que puede producirse una reducción importante en las concentraciones de lopinavir lo cual puede disminuir significativamente su efecto terapéutico. Corticosteroides. Propionato de fluticasona: el uso simultáneo de propionato de fluticasona y KALETRA puede incrementar las concentraciones del propionato de fluticasona. Puede producirse síndrome de Cushing y supresión adrenal cuando se coadministra ritonavir con propionato de fluticasona inhalado o intranasal. Casos similares pueden ocurrir con la coadministración de otros corticosteroides que se metabolizan de manera similar a la fluticasona como es el caso de budesonida. Se debe tener precaución cuando se coadministre KALETRA y cualquier glucocorticoide inhalado o intranasal (ver Precauciones). Agentes para la disfunción eréctil: utilice sildenafil, tadalafil o vardenafil con precaución coadministrados con KALETRA ya que los primeros pueden incrementar sus concentraciones que pueden resultar en eventos adversos asociados como hipotensión y erección prolongada (ver Precauciones). Preparaciones herbales: no se recomienda el uso concomitante de KALETRA y la Hierba de San Juan (Hypericum perforatum) o productos que contengan Hierba de San Juan. Se espera que la coadministración de inhibidores de proteasa, incluyendo KALETRA, con la Hierba de San Juan disminuya sustancialmente las concentraciones del inhibidor de proteasa y puede generar niveles subóptimos de KALETRA y conducir a pérdida de respuesta virológica y posible resistencia a KALETRA o a la clase de inhibidores de proteasa (ver Precauciones). Agentes reductores del colesterol: no se recomienda el uso concomitante de KALETRA con lovastatina o simvastatina. Se debe tener precaución si los inhibidores de proteasa del VIH, incluyendo KALETRA, son utilizados concomitantemente con otros inhibidores de la HMG-CoA reductasa, que también son metabolizados por la vía del CYP3A4; por ejemplo, atorvastatina. Se puede incrementar el riesgo de miopatía, incluyendo rabdomiólisis (ver Precauciones). Diabetes mellitus/hiperglucemia: durante la vigilancia posmercadeo en pacientes infectados por VIH que reciben tratamiento con inhibidores de proteasa, se ha informado de diabetes mellitus de inicio reciente, exacerbación de diabetes mellitus preexistente e hiperglucemia. Algunos pacientes requieren inicio o ajuste en las dosis de insulina o hipoglucemiantes orales para el tratamiento de estos eventos. En algunos casos, ha ocurrido cetoacidosis diabética. En aquellos pacientes que suspendieron el tratamiento con inhibidor de proteasa, la hiperglucemia persistió en algunos casos. Como estos eventos han sido informados voluntariamente durante la práctica clínica, no se pueden realizar estimativos de frecuencia y no se ha establecido una relación causal entre el tratamiento con inhibidores de proteasa y estos eventos. Pancreatitis: se han informado casos de pancreatitis en pacientes tratados con KALETRA, incluyendo a aquellos que desarrollaron elevaciones marcadas de triglicéridos. En algunas ocasiones con casos fatales. Si bien no se ha establecido una relación causal con la administración de KALETRA, las elevaciones marcadas de triglicéridos son un factor de riesgo para desarrollo de pancreatitis (ver Precauciones: Elevaciones de los lípidos). Los pacientes con enfermedad avanzada por VIH pueden estar en riesgo aumentado de triglicéridos elevados y pancreatitis, y los pacientes con historia de pancreatitis pueden estar en mayor riesgo de recurrencia durante el tratamiento con KALETRA. Alteraciones hepáticas: KALETRA es metabolizado por el hígado, principalmente, por tanto, se debe tener precaución cuando este medicamento se administre a los pacientes con insuficiencia hepática. KALETRA no ha sido estudiado en pacientes con daño hepático severo. Los datos farmacocinéticos sugieren aumento en las concentraciones plasmáticas de lopinavir en 30%, así como disminución en la unión a proteínas plasmáticas en pacientes con VIH coinfectados con VHC, y leve a moderada insuficiencia hepática. Los pacientes con hepatitis B o C, subyacente, o con marcada elevación de las transaminasas antes del tratamiento pueden estar en mayor riesgo de desarrollar elevación de transaminasas adicional. Han habido informes posmercadeo de disfunción hepática, incluyendo algunas muertes. Estas generalmente han ocurrido en pacientes con enfermedad por VIH avanzada, que toman múltiples medicamentos de manera concomitante, y en casos de hepatitis crónica o cirrosis. No se ha establecido una relación causal con el uso de KALETRA. Se debe considerar un incremento en el monitoreo de AST/ALT en esos pacientes, en especial durante los primeros meses de tratamiento con KALETRA. Resistencia/resistencia cruzada: se han observado grados variables de resistencia cruzada entre inhibidores de proteasa. El efecto del tratamiento con KALETRA sobre la eficacia de inhibidores de proteasa administrados subsecuentemente está bajo investigación. Hemofilia: han habido informes de incremento de sangrado, incluyendo hematomas espontáneos en la piel y hermartrosis, en pacientes con hemofilia tipos A y B tratados con inhibidores de proteasa. En algunos pacientes fue administrado factor VIII adicional. En más de la mitad de los casos informados, el tratamiento con inhibidores de proteasa fue continuado o reiniciado. No se ha establecido una relación causal entre el tratamiento con inhibidor de proteasa y estos eventos. Redistribución de grasa: se ha observado redistribución/acumulación de grasa corporal incluyendo obesidad central, aumento de la grasa dorsocervical (joroba de búfalo), adelgazamiento periférico, adelgazamiento facial, aumento de los senos y "apariencia cushingoide" en pacientes que reciben tratamiento antirretroviral. El mecanismo y las consecuencias a largo plazo de estos eventos son desconocidos actualmente. No se ha establecido una relación causal. Elevaciones de los lípidos: El tratamiento con KALETRA ha producido incrementos en la concentración de colesterol total y triglicéridos. La determinación de triglicéridos y colesterol se debe realizar antes de iniciar el tratamiento con KALETRA y a intervalos periódicos durante la terapia. Los trastornos de los lípidos deben ser manejados como es apropiado clínicamente. Ver Precauciones: síndrome de reconstitución inmune: este síndrome se ha reportado en pacientes tratados con terapia antirretroviral combinada incluyendo KALETRA. Durante la fase inicial de la respuesta inmune los pacientes pueden desarrollar una respuesta inflamatoria a infecciones asintomáticas o residuales oportunistas (como infección por Mycobacterium avium, citomegalovirus, neumonía por Pneumocystis jiroveci (antes carinii) o tuberculosis) que puede requerir posterior evaluación y tratamiento.
Restricciones de uso durante el embarazo y la lactancia: Lopinavir en combinación con ritonavir en una relación 2:1, no produjo efecto sobre la fertilidad en ratas con las dosis máximas administradas del medicamento, las cuales fueron comparables o ligeramente menores a las dosis terapéuticas recomendadas. No se observaron malformaciones relacionadas con la administración de KALETRA a conejas o ratas preñadas. La toxicidad sobre el desarrollo se observó en ratas (resorción temprana, viabilidad fetal disminuida, disminución del peso corporal fetal, alteraciones esqueléticas) y con dosificación materna a razón de 100/50 mg/kg/día correspondientes a 0,7 veces mayor para lopinavir y 1,8 veces mayor para ritonavir para hombres y mujeres para tratamiento en dosis terapéuticas. No se observó toxicidad sobre desarrollo en conejos con dosificación tóxica materna de 80/40 mg/kg/día (aproximadamente 0,6 veces mayor para lopinavir y 1,0 mayor para ritonavir), en relación con la dosis terapéutica recomendada en humanos. No hay estudios adecuados y bien controlados en la mujer embarazada. Como los estudios de reproducción animal no siempre predicen la respuesta humana, KALETRA sólo se debe utilizar durante el embarazo si los beneficios potenciales claramente superan los riesgos. Madres lactantes: en razón del potencial de transmisión del VIH y los posibles efectos adversos, se debe instruir a las madres para que no amamanten a sus hijos si ellas están recibiendo KALETRA. Estudios en ratas han demostrado que lopinavir se secreta en la leche. Se desconoce si lopinavir se secreta en la leche humana.
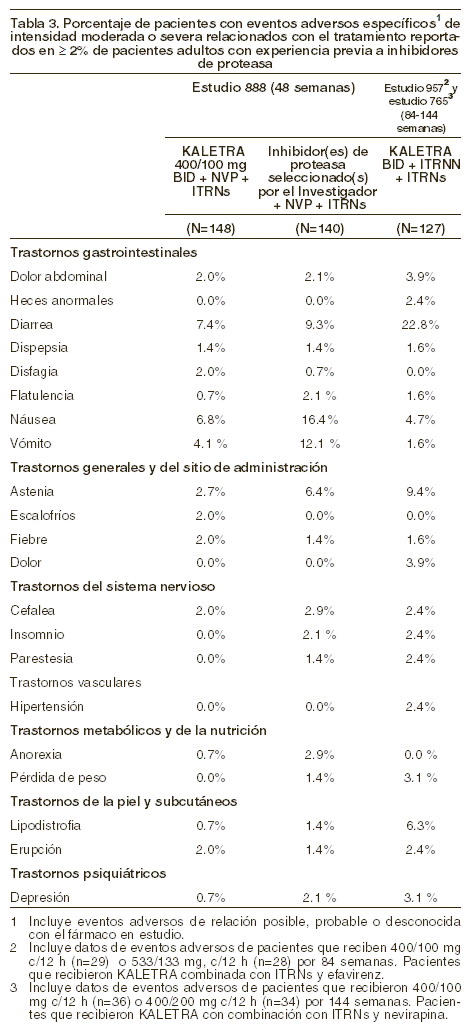
Reacciones secundarias y adversas: KALETRA ha sido estudiado en 891 pacientes como tratamiento de combinación, en estudios clínicos Fase I/II/III. El evento adverso más común asociado al tratamiento con KALETRA fue diarrea, la cual generalmente fue de severidad leve a moderada. La frecuencia de suspensión del tratamiento, asignado aleatoriamente, debido a eventos adversos incluyendo muerte fue 5,8% en los pacientes tratados con KALETRA y 4,9% en los tratados con nelfinavir en el estudio 863. La medicina incidencia de diarrea fue mayor para KALETRA cápsulas administradas una vez al día comparada con dos veces al día en el estudio 418 (ver tabla 2). Los eventos adversos clínicos, relacionados con el tratamiento, de intensidad moderada a severa en ≥2% de pacientes tratados con terapia de combinación que incluyó KALETRA hasta por 48 semanas y hasta por 360 semanas fase I y II, se presentan en las Tablas 2 y 3.

Infecciones e infestaciones: síndrome gripal, furunculosis, gastroenteritis, infección bacteriana, otitis media, faringitis, sialoadenitis, sinusitis e infección viral. Neoplasias benignas, malignas y no especificadas: quistes, neoplasias y neoplasias benignas de la piel. Alteraciones de los sistemas sanguíneo y linfático: anemia, leucopenia y linfadenopatía. Alteraciones del sistema inmune: reacciones alérgicas. Alteraciones endocrinas: síndrome de Cushing e hipotiroidismo. Alteraciones metabólicas y nutricionales: avitaminosis, deshidratación, diabetes mellitus, aumento del apetito, acidosis láctica, obesidad y ganancia de peso. Alteraciones psiquiátricas: sueños anormales, agitación, ansiedad, apatía, confusión, labilidad emocional, nerviosismo e ideas anormales. Alteraciones del sistema nervioso: amnesia, ataxia, infarto cerebral, crisis convulsivas, vértigo, discinesia, encefalopatía, síndrome extrapiramidal, parálisis facial, hipertonía, migraña, neuropatía, neuritis periférica, somnolencia, pérdida del gusto, alteraciones del gusto y temblor. Alteraciones oculares: visión anormal y alteraciones de los ojos. Alteraciones auditivas y del laberinto: zumbidos y vértigo. Alteraciones cardíacas: fibrilación auricular, infarto al miocardio y palpitaciones. Alteraciones vasculares: trombosis venosa profunda, hipotensión postural, tromboflebitis, venas varicosas y vasculitis. Alteraciones respiratorias, torácicas y mediastinales: asma, tos incrementada, disnea, edema pulmonar y rinitis. Alteraciones gastrointestinales: constipación, boca seca, enteritis, enterocolitis, eructos, esofagitis, incontinencia fecal, gastritis, colitis hemorrágica, ulceración bucal, pancreatitis, periodontitis, estomatitis y estomatitis ulcerosa. Alteraciones hepatobiliares: colangitis, colecistitis, hepatitis, hepatomegalia, ictericia, depósitos grasos hepáticos e hipersensibilidad hepática. Alteraciones de piel y tejidos blandos: acné, alopecia, piel reseca, eccema, dermatitis exfoliativa, edema facial, erupción maculopapular, alteraciones ungueales, prurito, seborrea, decoloración cutánea, ulceras cutáneas, estrías cutáneas y sudoración. Alteraciones musculoesqueléticas y del tejido conectivo: artralgias, artrosis, dolor lumbar, necrosis ósea, alteraciones articulares y miastenia. Alteraciones renales y urinarias: cálculos renales, nefritis y anormalidades urinarias. Alteraciones del sistema reproductivo: eyaculación anormal, crecimiento mamario, ginecomastia e impotencia. Alteraciones generales y condiciones del sitio de administración: dolor torácico, dolor torácico subesternal, interacciones farmacológicas, edema, hipertrofia, malestar general y edema periférico. Investigaciones: aumento del nivel del fármaco y disminución de la tolerancia a la glucosa. Experiencia postregistro: en pacientes bajo tratamiento con KALETRA se ha reportado hepatitis, síndrome de Stevens-Johnson, eritema multiforme y bradiarritmia.
Interacciones medicamentosas y de otro género: KALETRA es un inhibidor de CYP3A (citocromo P450 3A) in vivo e in vitro. La coadministración de KALETRA y fármacos metabolizados principalmente por CYP3A (por ejemplo bloqueadores de los canales de calcio, inhibidores de HMG-CoA reductasa, inmunosupresores y sildenafil) puede resultar en concentraciones plasmáticas incrementadas de los otros fármacos que puedan aumentar o prolongar su efecto terapéutico y efectos indeseables (ver Precauciones). Los medicamentos contraindicados específicamente debido a la magnitud esperada de interacción y potencial para eventos serios indeseables se listan en la Tabla 1 en el segmento de Contraindicaciones. KALETRA es metabolizado por el CYP3A. La coadministración de KALETRA y los fármacos que inducen el CYP3A puede disminuir las concentraciones plasmáticas de lopinavir y reducir sus efectos terapéuticos. Aunque no se ha observado con la administración concomitante de ketoconazol, la coadministración de KALETRA y otros fármacos que inhiben el CYP3A puede incrementar las concentraciones plasmáticas de lopinavir. Agentes anti-VIH: inhibidores de la transcriptasa inversa nucleósidos - nucléotidos (ITRN): estavudina y lamivudina: no se observó ningún cambio en la farmacocinética de lopinavir cuando KALETRA fue administrado solo o en combinación con estavudina y lamivudina. Didanosina: se recomienda que didanosina se administre con el estómago vacío; por lo tanto, didanosina se debe administrar una hora antes o dos horas después de KALETRA (administrar con los alimentos). Zidovudina y abacavir: KALETRA induce glucuronidación, por lo tanto tiene el potencial de reducir las concentraciones plasmáticas de zidovudina y abacavir. Se desconoce el significado clínico de esta potencial interacción. Tenofovir: KALETRA incrementa las concentraciones de tenofovir por mecanismos aún no conocidos. Su uso simultáneo debe vigilarse por los posibles eventos adversos. Todos: se ha reportado incremento en CPK, mialgia, miositis y rabdomiólisis raramente con el uso de IPs, particularmente en combinación con ITRN. Inhibidores de la transcriptasa inversa no nucleósidos (ITRNN): nevirapina: durante la coadministración de KALETRA y nevirapina a sujetos adultos sanos no se observaron cambios en la farmacocinética de Lopinavir. Cuando KALETRA se administró con nevirapina en estudios clínicos pediátricos se observa que las concentraciones de lopinavir podrían verse disminuidas. Se espera la misma observación en pacientes adultos. El significado clínico de esta interacción es desconocida. KALETRA no debe administrarse una vez al día en combinación con nevirapina. Efavirenz: el incremento en la dosis de KALETRA tabletas a 600/150 (tres tabletas) c/12 h coadministrados con efavirenz incrementaron significativamente las concentraciones de lopinavir aproximadamente 36% y ritonavir 56% a 92% en comparación con la administración de KALETRA tabletas a razón de 400/100 mg c/12 h sin efavirenz. Nota: efavirenz y nevirapina inducen la actividad del CYP3A y por lo tanto tiene el potencial de disminuir las concentraciones plasmáticas de otros inhibidores de proteasa cuando se usan en combinación con KALETRA. KALETRA no debe administrarse una vez al día en combinación en efavirenz. Delavirdina: delavirdina tiene el potencial de incrementar las concentraciones plasmáticas de lopinavir. Inhibidores de proteasa (IPs): amprenavir: KALETRA incrementa las concentraciones de amprenavir. La coadministración de KALETRA y amprenavir da como resultado una disminución en las concentraciones de lopinavir. KALETRA no debe administrarse una vez al día en combinación con amprenavir. Fosamprenavir: su coadministración con KALETRA disminuye las concentraciones de lopinavir y amprenavir. Las dosis apropiadas en la combinación con respecto a seguridad y eficacia no han sido establecidas. Indinavir: KALETRA incrementa las concentraciones de indinavir. La dosis de indinavir podría requerir una disminución durante la coadministración con KALETRA. KALETRA una vez al día no se ha estudiado en combinación con indinavir. Nelfinavir: KALETRA incrementa las concentraciones de nelfinavir y el metabolito activo M8. La coadministración con KALETRA reduce las concentraciones de lopinavir. KALETRA no debe ser administrado una vez al día en combinación con nelfinavir. Ritonavir: cuando KALETRA se coadministró con ritonavir adicional 100 dos veces al día, el ABC de lopinavir se incrementó 33% y Cmín se incrementó 64%, en comparación con KALETRA 400/100 mg (tres cápsula) cada 12 horas. Saquinavir: KALETRA incrementa las concentraciones de saquinavir. Puede ser necesario disminuir la dosis de saquinavir cuando se coadministra con KALETRA 400/100 mg c/12 h. KALETRA una vez al día no ha sido estudiado en combinación con saquinavir. Tipranavir: en un estudio de doble IP reforzado en pacientes adultos pretratados, tipranavir 500 mg con ritonavir 200 mg c/12 horas coadministrados con KALETRA (400/100 mg c/12 horas) mostró una reducción del 47% y 70% en el ABC y Cmín de lopinavir respectivamente, por lo que el uso simultáneo de KALETRA y tipranavir con dosis bajas de ritonavir no se recomienda. Otros fármacos: antiarrítmicos: las concentraciones de amiodarona, bepridil, lidocaína (sistémica) y quinidina se pueden incrementar cuando se coadministran con KALETRA. Se debe tener precaución y se recomienda monitorizar las concentraciones terapéuticas cuando sea factible. Digoxina: la coadministración de ritonavir (300 mg c/12 h) y digoxina muestra una elevación significativa de los niveles de digoxina de acuerdo con un reporte de la literatura. Se debe tener precaución cuando se coadministre KALETRA con digoxina a través de un monitoreo adecuado de los niveles de digoxina. Anticoagulantes: las concentraciones de warfarina se pueden afectar cuando se coadministra con KALETRA. Se recomienda monitorizar el INR (International Normalized Ratio). Antidepresivos: trazodona: sus niveles pueden elevarse con el uso simultáneo de ritonavir. Se han observado náusea, mareo, hipotensión y síncope como efectos secundarios. Su uso simultáneo con KALETRA debe ser con precaución considerando dosis menores de trazodona. Anticonvulsivantes: carbamazepina, fenobarbital y fenitoína son inductores del CYP3A4 y pueden disminuir las concentraciones plasmáticas de lopinavir. KALETRA no debe administrarse una vez al día con fenobarbital, fenitoína o carbamazepina. Antimicóticos: ketoconazol e itraconazol pueden elevar sus concentraciones cuando se coadministran con KALETRA. No se recomiendan dosis altas de ketoconazol e itraconazol (mayores de 200 mg/día). Voriconazol: la coadministración con ritonavir 400 mg c/12 h disminuye el ABC de voriconazol en promedio 82% de acuerdo con un reporte, por lo tanto la administración simultánea con KALETRA no se recomienda. Antiinfecciosos: se esperan moderados incrementos en el ABC de claritromicina cuando se coadministra con KALETRA. En pacientes con alteraciones renales o hepáticas se debe reducir la dosis de claritromicina. Antimicobacterianos: se recomienda que se reduzca la dosis de rifabutina 75% (150 mg cada tercer día o tres veces por semana) cuando se coadministra con KALETRA por el incremento notable en las concentraciones de la primera. El uso de rifampicina con KALETRA puede llevar a pérdida de la respuesta virológica y posible resistencia a KALETRA, o a la clase de inhibidores de proteasa u otros agentes antirretrovirales coadministrados. Un estudio evaluó la combinación de rifampicina 600 mg, cada 24 horas con KALETRA 800/200 mg, cada 12 horas o KALETRA 400/100 mg más ritonavir 300 mg, cada 12 horas. Los resultados farmacocinéticos y de seguridad, no permiten la recomendación de dosis. Nueve sujetos (28%) tuvieron ≥ grado 2 de aumento en ALT/AST, de los cuales siete (21%) suspendieron el estudio prematuramente. Con base en el diseño del estudio, no es posible determinar si la frecuencia o la magnitud de la elevación de ALT/AST observadas son mayores que las que pudieran ser vistas con rifampicina sola. Antiparasitarios: pueden ser necesarios incrementos en la dosis de atovacuona dada la disminución de las concentraciones de esta en coadministración con KALETRA. Corticoesteroides: dexametasona puede inducir la CYP3A4 y puede disminuir las concentraciones plasmáticas de lopinavir. Propionato de fluticasona: su uso simultáneo con KALETRA puede incrementar las concentraciones del propionato de fluticasona. Utilícese con precaución. Considere alternativas para el propionato de fluticasona, especialmente para su uso a largo plazo (ver Precauciones). Bloqueadores de los canales de calcio: los agentes dihidropiridínicos (por ejemplo, felodipina, nifedipina, nicardipina) pueden aumentar sus concentraciones cuando se coadministran con KALETRA. Agentes para la disfunción eréctil: sildenafil: utilice este medicamento con precaución a dosis reducidas de 25 mg c/48 horas. con estrecha vigilancia de eventos adversos (ver Precauciones). Tadalaf
