MOBICOX®
BOEHRINGER PM
Solución inyectable
Denominación genérica: Meloxicam.
Forma farmacéutica y formulación: Solución inyectable. Cada ampolleta contiene: meloxicam 15 mg. Vehículo c.b.p. 1,5 ml.
Indicaciones terapéuticas: MOBICOX® es un antiinflamatorio no esteroideo, indicado para el tratamiento sintomático inicial y a corto plazo de la artritis reumatoide, osteoartritis dolorosa, (artrosis, enfermedad articular degenerativa) y la espondilitis anquilosante, de la periartritis de hombro y cadera, así como de las distensiones musculares y de los ataques de gota. Util para el tratamiento de la inflamación y del dolor secundario a traumatismos, así como de los procesos inflamatorios de tejidos blandos (vías aéreas), padecimientos ginecológicos, dismenorrea primaria.
Farmacocinética y farmacodinamia: Farmacocinética: absorción: meloxicam, principio activo de MOBICOX®, es completamente absorbido después de la administración intramuscular. La biodisponibilidad relativa es comparable con la administración oral cercana al 100%. Por tanto, el cambio de administración de intramuscular a oral no requiere ajuste de dosis. Seguido a la administración intramuscular de 15 mg de meloxicam, el pico de concentración plasmática máxima es de aproximadamente 1,62 mcg/ml, la cual se alcanza aproximadamente a los 60 minutos después de la administración. Distribución: meloxicam se une fuertemente a las proteínas plasmáticas, esencialmente a albúmina (99%). El meloxicam penetra en el líquido sinovial alcanzando concentraciones hasta de un 50% de las encontradas en plasma. El volumen de distribución promedio es bajo (11 l). La variación interindividual es en el orden de 30 a 40%. Biotransformación: el meloxicam sufre una extensa biotransformación hepática, se metaboliza casi completamente en cuatro metabolitos farmacológicamente inactivos identificados en la orina. El principal es el 5'carboximeloxicam (60% de la dosis), mismo que se forma de la oxidación de un metabolito intermedio, el 5'-hidroximetilmeloxicam, que también es excretado en forma menos extensa (9% de la dosis). Los estudios in vitro sugieren que el CYP 2C9 juega un papel importante dentro de esta ruta metabólica, con una contribución menor de la isoenzima CYP 3A4. La actividad de la peroxidasa del paciente es probablemente responsable de la formación de los otros dos metabolitos, los cuales corresponden al 16 y al 4% de la dosis administrada respectivamente. Eliminación: la excreción del meloxicam se realiza predominantemente en forma de metabolitos y ocurre en cantidades iguales tanto en las heces como en la orina. Menos del 5% de la dosis diaria administrada se elimina inalterada en las heces, mientras que solo trazas del compuesto original son las encontradas en la orina. El meloxicam presenta una vida media promedio de 20 horas aproximadamente. El aclaramiento plasmático es de 8 ml/min. Linearidad/no linearidad: meloxicam demuestra una farmacocinética lineal en dosis terapéuticas en rango de 7,5mg a 15 mg seguida de su administración por vía oral o intramuscular. Poblaciones especiales: insuficiencia hepática y renal: ni la insuficiencia hepática ni la insuficiencia renal leve o modera presentan efectos sustanciales sobre la farmacocinética del meloxicam. En la insuficiencia renal terminal, el incremento en el volumen de distribución puede resultar en mayores concentraciones de meloxicam libre y no se debe exceder una dosis diaria de 7,5 mg. Ancianos: el aclaramiento plasmático en estado estable en sujetos ancianos fue ligeramente menor con lo reportado en sujetos jóvenes. Farmacodinamia: MOBICOX® es un antiinflamatorio no esteroideo (AINE) del grupo del ácido enólico, el cual ha mostrado poseer propiedades antiinflamatoria, analgésica y antipirética en animales. meloxicam tiene una actividad potente antiinflamatoria demostrada en todos los modelos estándares de la inflamación. Un mecanismo común para los efectos anteriores se deriva de la capacidad del meloxicam de inhibir la biosíntesis de prostaglandinas, conocidas como mediadores de la inflamación. La comparación de la dosis ulcerogénica y la dosis antiinflamatoria efectiva en un modelo de artritis en ratas confirmó un margen terapéutico superior sobre otros AINE's. In vivo, el meloxicam inhibe la biosíntesis de prostaglandinas con mayor potencia en el sitio de inflamación que de la mucosa gástrica o el riñón. Se ha postulado que tal acción puede estar relacionada con la inhibición selectiva de la COX-2 respecto a la COX-1 y se cree que la inhibición de la COX-2 provee el efecto terapéutico de los AINE's mientras que la inhibición de la COX-1 puede ser responsable de los efectos adversos gástricos y renales. La selectividad de COX-2 de meloxicam se ha confirmado tanto in vitro así como ex vivo en un número de sistemas de análisis. En el ensayo en sangre pura humana, el meloxicam ha mostrado, in vitro, inhibir selectivamente a la COX-2. El meloxicam demostró (7,5 mg y 15 mg) una mayor inhibición de COX-2 ex vivo, como se demostró por una mayor inhibición de la producción de PGE2 estimulada por el lipopolisacáridos (COX-2) cuando se comparó con la producción de tromboxano en la coagulación de la sangre (COX-1). Estos efectos fueron dependientes de la dosis. El meloxicam demostró no tener efecto en la agregación plaquetaria o en el tiempo de sangrado en dosis recomendadas ex vivo, mientras que la indometacina, diclofenaco, ibuprofeno y naproxeno inhiben significativamente la agregación plaquetaria y prolongan el sangrado. En los estudios clínicos, los eventos adversos gastrointestinales fueron reportados menos frecuentemente con meloxicam 7,5 mg y 15 mg que con otros AINE's con los cuales fue comparado, debido principalmente a la baja incidencia de eventos tales como la dispepsia, vómito, náusea y dolor abdominal. La incidencia de perforación gastrointestinal superior, úlceras y sangrados reportados y atribuidos a meloxicam es baja y dependiente de la dosis. No hay un solo estudio conducido adecuadamente para detectar diferencias estadísticas en la incidencia de perforación gastrointestinal superior, obstrucción o sangrado clínicamente significativo entre meloxicam y otros AINEs. Un análisis global ha sido conducido involucrando pacientes tratados con meloxicam diariamente en 35 estudios clínicos en las indicaciones de osteoartritis, artritis reumatoide y espondilitis anquilosante. La exposición al meloxicam en estos estudios abarcó periodos de tres semanas hasta un año (la mayoría fueron enrolados en los estudios a un mes). Casi todos los pacientes que participaron en estos estudios tenían antecedentes de perforaciones gastrointestinales, úlceras o sangrado. La incidencia de perforación gastrointestinal superior, obstrucción o sangrado con significado clínico fue analizada retrospectivamente siguiendo de forma ciega e independiente en cada caso. Los resultados se muestran en la siguiente tabla:
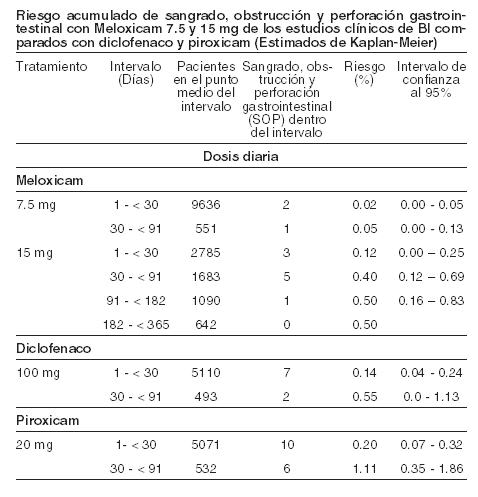
Contraindicaciones: Hipersensibilidad conocida al principio activo o a los componentes de la fórmula. Existe un riesgo potencial de sensibilidad cruzada con el ácido acetilsalicílico y otros antiinflamatorios no esteroideos, por lo que no debe ser utilizado en pacientes en los que la administración previa de dichos fármacos haya dado lugar a manifestaciones de asma, angioedema, pólipos nasales o urticaria. MOBICOX® Solución inyectable no deberá ser usada en pacientes que se encuentren en tratamiento con anticoagulantes, dado que pueden formarse hematomas intramusculares. Tampoco deberá emplearse en los siguientes casos: ulceración/perforación activa o reciente de origen gastrointestinal. Enfermedad intestinal inflamatoria activa (enf. de Crohn o colitis ulcerativa). Insuficiencia hepática severa. Insuficiencia renal severa no dializada. Sangrado gastrointestinal patente, sangrado cerebrovascular reciente o trastornos de sangrado sistémicos ya establecidos. Falla cardíaca no controlada o severa. Niños y adolescentes menores de 15 años. Embarazo y lactancia. MOBICOX® está contraindicado para el tratamiento de dolor perioperatorio secundario a la colocación de bypass coronario.
Precauciones generales: Al igual que con otros AINEs, se deben de tomar precauciones cuando se traten pacientes con historia de enfermedad gastrointestinal. Los pacientes con síntomas gastrointestinales deben de ser monitoreados. Se deberá descontinuar el uso de MOBICOX® si ocurre ulceración péptica o sangrado gastrointestinal. Al igual que con otros AINEs, sangrado gastrointestinal, ulceraciones o perforaciones potencialmente fatales pueden ocurrir en cualquier momento durante el tratamiento, con o sin síntomas de alarma o historia previa de eventos gastrointestinales serios. Las consecuencias de tales eventos son generalmente más serias en pacientes de edad avanzada. Se han reportado muy raramente reacciones dérmicas serias, alguna de ellas fatales asociadas con el uso de AINEs; estas incluyen dermatitis exfoliativa, síndrome de Stevens-Johnson y necrolisis tóxica epidérmica. Aparentemente, los pacientes están en un mayor riesgo de estas reacciones en las etapas tempranas de la terapéutica el inicio de las reacciones ocurren en la mayoría de los casos en el primer mes de tratamiento. MOBICOX® deberá suspenderse si aparece rash, lesiones en mucosas o cualquier otro signo de hipersensibilidad. Los AINEs pueden incrementar el riesgo de aparición de eventos trombóticos cardiovasculares serios, infarto al miocardio y accidentes cerebrovasculares agudos, los cuales pueden ser fatales. El riesgo aumenta cuando el tiempo de administración es prolongado. Pacientes con enfermedad cardiovascular o factores de riesgo para enfermedad cardiovascular pueden tener un mayor riesgo. Los AINEs inhiben la síntesis de prostaglandinas renales, las cuales juegan un rol de apoyo en el mantenimiento de la perfusión renal. En los pacientes cuyo flujo sanguíneo renal o volumen sanguíneo se encuentre disminuido, la administración de un AINE puede precipitar una evidente descompensación renal, la cual es típicamente seguida del retorno al estado anterior al tratamiento tras la suspensión de la terapia antiinflamatoria no esteroidea. Los pacientes que presentan un mayor riesgo de tales reacciones son pacientes ancianos, deshidratados, aquellos con falla cardíaca congestiva, cirrosis hepática, síndrome nefrótico y una evidente enfermedad renal, aquellos que hayan recibido un tratamiento con diuréticos, IECA II o que se les haya practicado una intervención quirúrgica mayor que los haya conducido a hipovolemia. En estos pacientes, el volumen de diuresis y la función renal deben ser cuidadosamente monitorizados desde el inicio del tratamiento. En raras ocasiones, los AINEs pueden generar nefritis intersticial, glomerulonefritis, necrosis medular renal o síndrome nefrótico. Como con otros AINEs, ocasionalmente se han reportado elevaciones de transaminasas séricas u otros parámetros de función hepática. En la mayoría de los casos, éstos han sido pequeños aumentos y transitorios aumentos sobre el rango de normalidad. Si la anormalidad es significativa o persistente, MOBICOX® deberá ser suspendido y continuar con exámenes de revisión. No se requiere realizar una reducción en la dosis en pacientes con cirrosis hepática clínicamente estable. Los pacientes frágiles o debilitados pueden tener menos tolerancia a los efectos secundarios, por lo que deben ser supervisados cuidadosamente. Al igual que como con otros AINEs, se deberá tener precaución cuando se utilice en pacientes en edad avanzada, en los cuales es más probable pueda existir alteración de la función renal, hepática o presenten una función cardiaca deteriorada. La inducción de la retención de sodio, potasio y de líquidos, así como la interferencia con los efectos natriuréticos de los diuréticos, pueden ser exacerbadas tras la administración de AINEs. Como resultado, se puede ver precipitada o exacerbarse tanto la insuficiencia cardíaca como la hipertensión arterial en pacientes susceptibles, por lo que es recomendable el monitoreo clínico en este tipo de pacientes. Como cualquier otro AINE, MOBICOX® puede enmascarar síntomas de una enfermedad infecciosa subyacente. El uso del meloxicam, al igual que con cualquier fármaco que inhiba la síntesis de ciclooxigenasas/prostaglandinas, puede interferir con la fertilidad, por lo que no se recomienda en mujeres que pretendan concebir. Por lo tanto, se debe considerar la interrupción del meloxicam en mujeres con dificultad para concebir o en aquellas que se encuentran bajo investigación de infertilidad. Para las interacciones relevantes de MOBICOX® que requieren atención particular, ver en la sección de Interacciones medicamentosas y de otro género. No existen estudios específicos acerca de los efectos sobre la capacidad para conducir vehículos o el uso de maquinaria. Los pacientes que experimenten alteraciones visuales, mareos u otros trastornos del sistema nervioso central deberán sustraerse de tales actividades
Restricciones de uso durante el embarazo y la lactancia: MOBICOX® está contraindicado durante el embarazo y la lactancia. La inhibición de la síntesis de prostaglandinas puede afectar adversamente el curso del embarazo y/o el desarrollo embrio-fetal. Datos de estudios epidemiológicos sugieren un incremento del riesgo aumentado de aborto, de malformaciones cardíacas y gastrosquisis posterior al uso de inhibidores de la síntesis de prostaglandinas en etapas tempranas del embarazo. El riesgo absoluto para malformación cardiovascular se aumentó de menos de 1% hasta aproximadamente 1,5%. Se cree que el riesgo aumenta en relación con la dosis y el tiempo de duración de la terapia. En animales, la administración de inhibidores de la síntesis de prostaglandinas ha dado como resultado un incremento en la pérdida del ovocito antes y después de la implantación y un aumento en la mortalidad embrio-fetal. Agregado a esto, se ha reportado en animales que recibieron inhibidores de la síntesis de la prostaglandina durante el período organogénico un incremento en la incidencia de malformaciones, incluyendo cardiovasculares. Durante el tercer trimestre del embarazo, todos los inhibidores de la síntesis de prostaglandinas pueden exponer al feto a: toxicidad cardiopulmonar (con cierre prematuro del conducto arterioso e hipertensión pulmonar). Disfunción renal, que puede progresar a falla renal con oligohidramnios; la madre y el neonato, en el final del embarazo: posibilidad de prolongación del tiempo de sangrado, los efectos antiagregantes pueden ocurrir inclusive con dosis bajas. Alargamiento del tiempo de labor, secundario a inhibición de las contracciones uterinas resultando en un retaso en el trabajo de parto o trabajo de parto prolongado. No existe ninguna experiencia específica con MOBICOX®, pero se sabe que los AINEs son fármacos que son excretados por leche materna, por lo que su administración está contraindicada en mujeres que se encuentran en período de lactancia.
Reacciones secundarias y adversas: Los siguientes eventos adversos que pueden tener causa relacionada con la administración de MOBICOX® han sido reportados. Los eventos adversos que pueden estar causalmente relacionados a la administración de meloxicam han resultado de los reportes relacionados con la administración del medicamento comercializado rastreado por su número de referencia: alteraciones de la sangre y sistema linfático: cuenta sanguínea anormal (incluyendo cuenta diferencial de células blancas), leucopenia,trombocitopenia y anemia. La administración concomitante con medicamentos potencialmente mielotóxicos, en particular metotrexato, parece ser un factor predisponente de citopenia. Alteraciones del sistema inmune: reacciones anafilácticas, reacciones anafilactoides y otras reacciones de hipersensibilidad inmediata. Alteraciones psiquiátricas: estado confusional, desorientación, alteración del estado de ánimo. Alteraciones del sistema nervioso: mareo, somnolencia y cefalea. Alteraciones oculares: alteraciones en la visión incluyendo visión borrosa, conjuntivitis. Alteraciones del oído y laberinto: vértigo, tinitus. Alteraciones cardíacas: palpitaciones. Alteraciones vasculares: incremento en la presión sanguínea, ruborización. Alteraciones respiratorias, torácicas y mediastinales: asma en individuos alérgicos a la aspirina u otros AINEs. Alteraciones gastrointestinales: perforación gastrointestinal, hemorragia gastrointestinal oculta o macroscópica. Ulcera gastroduodenal, colitis, gastritis, esofagitis, estomatitis, dolor abdominal, dispepsia, diarrea, náusea, vómito, constipación, flatulencia, singultos. La hemorragia gastrointestinal, la ulceración o perforación pueden ser potencialmente fatales. Alteraciones hepatobiliares: hepatitis, pruebas de función hepática anormales (p. ej., aumento en las transaminasas o bilirrubina). Alteraciones de la piel y tejido celular subcutáneo: necrólisis epidérmica tóxica, síndrome de Stevens-Johnson, angioedema, dermatitis bulosa, eritema multiforme, rash, urticaria, reacción de fotosensibilidad y prurito. Alteraciones renales y urinarias: falla renal aguda, pruebas de función renal anormales (aumento de creatinina sérica y/o urea sérica. El uso de AINEs puede estar relacionado con alteraciones en la micción, incluyendo retención urinaria aguda. Alteraciones generales: edema, aumento de volumen (masa) en el sitio de inyección. Dolor en el sitio de inyección.
Interacciones medicamentosas y de otro género: Otros inhibidores de la síntesis de prostaglandina (PSI), incluyendo glucocorticoides y salicilatos (ácido acetilsalicílico): la coadministración de PSI puede incrementar el riesgo de ulceración gastrointestinal y sangrado a través de una acción sinérgica. No se recomienda el uso concomitante de meloxicam con otros AINEs. La administración concomitante de aspirina (1000 mg tres veces al día) a voluntarios sanos tendió a aumentar el área bajo la curva (10%) y la concentración plasmática máxima (24%) de meloxicam. Se desconoce la importancia clínica de esta interacción. Inhibidores selectivos de la recaptura de serotonina (ISRS): incrementa el riesgo de sangrado gastrointestinal. Litio: la administración de AINEs se ha asociado al incremento de los niveles séricos de litio. (por medio de una disminución de la excreción renal de litio), lo cual puede originar valores tóxicos. No se recomienda el uso concomitante de litio y AINEs. Si esta combinación es necesaria, se deben monitorear cuidadosamente las concentraciones de litio en plasma durante el inicio, ajuste e interrupción del tratamiento con meloxicam. Metotrexato: los AINEs pueden reducir la secreción tubular del metotrexato aumentando así las concentraciones de éste en plasma. Por esta razón, no se recomienda el uso concomitante de AINEs en pacientes con altas dosis de metotrexato (más de 15 mg/semana). El riesgo de una interacción entre AINEs y el metotrexato se debe considerar también en pacientes con dosis baja de metotrexato, especialmente en pacientes con función renal alterada. En caso de ser necesaria la terapia concomitante, se debe monitorizar el conteo de glóbulos rojos en sangre y la función renal. Se debe tener cuidado en caso de que se administren concomitantemente el AINE y el metotrexato durante 3 días, en cuyo caso el nivel en plasma del metotrexato se puede incrementar y provocar con ello un aumento de la toxicidad. Aunque la farmacocinética del metotrexato (15 mg/semana) no se afectó en forma relevante por el tratamiento concomitante con el meloxicam, se debe considerar que la toxicidad hematológica del metotrexato se puede incrementar al administrarse de forma concomitante con AINEs. Anticonceptivos: con el uso de AINEs se ha reportado un descenso de la eficacia de dispositivos intrauterinos, pero se requiere mayor información. Diuréticos: en pacientes deshidratados, el tratamiento con AINEs se ha asociado con un riesgo potencial de insuficiencia renal aguda. Los pacientes a los cuales se les administre MOBICOX® conjuntamente con un diurético deben ser adecuadamente hidratados y vigilados acerca de su función renal antes de iniciar el tratamiento. Antihipertensivos: (ej. beta-bloqueadores, inhibidores de la ECA, vasodilatadores y diuréticos): se ha reportado una disminución en el efecto de los antihipertensivos debido a la inhibición de las prostaglandinas vasodilatadoras durante el tratamiento con AINEs. AINEs y antagonistas de los receptores de angiotesina II, así como IECAs, ejercen un efecto sinérgico en el decremento de la filtración glomerular. En pacientes con alteración renal preexistente, esta combinación puede llevar a insuficiencia renal aguda. La colestiramina unida al meloxicam en el tracto gastrointestinal favorece su eliminación. La nefrotoxicidad de la ciclosporina puede intensificarse por el uso de AINEs debido a los efectos sobre las prostaglandinas en la vía renal. Durante el tratamiento combinado, se debe de vigilar la función renal. El meloxicam es eliminado casi totalmente por el metabolismo hepático, del cual aproximadamente dos terceras partes se encuentran mediadas por las enzimas del citocromo (CYP) P450 (vía primaria CYP 2C9 y vía secundaria CYP 3A4) y una tercera parte por otras vías tales como la oxidación por la peroxidasa. El potencial de una interacción farmacocinética debe de tomarse en cuenta cuando el meloxicam y fármacos conocidos que pudieran inhibir o sean metabolizados por el CYP 2C9 y/o CYP 3A4 sean administrados concomitantemente. No se han detectado interacciones farmacocinéticas fármaco-fármaco con respecto a la administración concomitante de antiácidos, cimetidina, digoxina y furosemida. Las interacciones con hipoglucemiantes orales no pueden ser excluidas.
Alteraciones en los resultados de pruebas de laboratorio: Al igual que con otros AINEs, ocasionalmente pueden presentarse elevaciones de las transaminasas séricas o de otros indicadores de la función hepática. En la mayoría de los casos, estas elevaciones han sido discretas y transitorias y han remitido sin necesidad de interrumpir la medicación. Si esta anomalía llegara a ser significativa o persistente, deberá suspenderse la administración del medicamento y deberán practicarse los estudios indicados para el caso.
Precauciones en relación con efectos de carcinogénesis, mutagénesis, teratogénesis y sobre la fertilidad: Un extenso programa de toxicología demostró que meloxicam tiene un perfil de seguridad aceptable. Estudios de toxicidad con dosis repetidas en ratas y cobayos mostraron cambios característicos de los reportados con otros AINES, por ejemplo, ulceración gastrointestinal, erosión y en los estudios a largo plazo necrosis papilar renal. Después de la administración intravenosa, dosis de 0.4 mg/kg y mayores en ratas y de 9 mg/kg en cobayos causaron lesiones gastrointestinales. Necrosis papilar renal ocurrió solo en ratas a dosis de 0,6 mg/kg o mayores después de exposiciones prolongadas con meloxicam. Estudios de toxicología sobre la reproducción en ratas y conejos no revelaron teratogenisidad después de dosis de 4 mg/kg en ratas y 80 mg/kg en conejos. Estudios reproductivos en ratas han mostrado un decremento en la ovulación e implantación así como efectos embriotóxicos (incremento en la resorción) en dosis maternotóxicas de 1 mg/kg y mayores. Estas dosis exceden de 5 a 10 veces a las dosis clínicas (7,5 - 15 mg) basado en un modelo de 75 kg. Los efectos fetotóxicos al final de la gestación, compartidos por todos los inhibidores de prostaglandinas, han sido descritos. Meloxicam no fue mutagénico en el estudio de AMES. Los estudios de carcinogenicidad en ratas y ratones no mostraron un potencial carcinogénico con dosis mayores de 0,8 mg/kg en ratas y de 8mg/kg en ratones. En los estudios realizados meloxicam fue condro-neutral, es decir, no dañó el cartílago articular durante la exposición a largo plazo. Meloxicam no indujo reacciones inmunogénicas en ratones y cobayos. En algunos estudios, meloxicam resultó ser menos fototóxico que otros AINES antiguos pero similar respecto de piroxicam y tenoxicam. En los estudios de toxicidad local, MOBICOX® Solución inyectable fue bien tolerado.
Dosis y vía de administración: Vía de administración: intramuscular profunda. La administración intramuscular debe ser empleada únicamente durante los primeros días de tratamiento. Para la continuación del tratamiento, deben emplearse las tabletas de MOBICOX® de 7,5 mg o 15 mg una vez al día, dependiendo de la intensidad del dolor y la severidad de la inflamación. Debido a que el potencial para desarrollar reacciones adversas aumenta de acuerdo con la dosis y duración de la exposición, se recomienda utilizar la duración más corta posible y la dosis diaria efectiva más baja. MOBICOX® deberá ser administrado por inyección intramuscular profunda, nunca por vía intravenosa. MOBICOX® Solución inyectable no debe ser administrado por vía intravenosa. Debido a la posibilidad de incompatibilidad, MOBICOX® no debe de mezclarse con otro tipo de medicamentos o sustancias en la misma jeringa. En pacientes con insuficiencia renal terminal con diálisis, la dosis no deberá exceder los 7.5 mg al día. Debido a que no se ha establecido la dosificación para adolescentes y niños, el uso de MOBICOX® solución inyectable queda restringido a pacientes adultos. Administración combinada: la dosis diaria total de MOBICOX®, incluso combinando diferentes formas farmacéuticas, no deberá exceder los 15 mg.
Manifestaciones y manejo de la sobredosificación o ingesta accidental: En caso de sobredosificación o de ingesta accidental, se deben usar medidas generales de soporte ya que no hay algún antídoto conocido. En un estudio clínico, se ha observado que la colestiramina acelera la eliminación del meloxicam.
Presentación(es): Caja con 3 ampolletas con 1,5 ml (15 mg).
Recomendaciones sobre almacenamiento: Consérvense a temperatura ambiente a no más de 30°C.
Leyendas de protección: Literatura exclusiva para médicos. Léase inserto anexo. Dosis: la que el médico señale. Su venta requiere receta médica. No se deje al alcance de los niños. No se use en el embarazo, ni en la lactancia, ni en niños menores de 15 años. Si no se administra todo el producto, deséchese el sobrante. No se administre si la solución no es transparente, si contiene partículas en suspensión o sedimentos.
Nombre y domicilio del laboratorio: Hecho en España por: según fórmula de: Boehringer Ingelheim España S.A. Boehringer Ingelheim International, Prat de la Riba s/n, GmbH, Sector Turó de Can Matas, Ingelheim am Rhein, 08173, Sant Cugat del Vallés, Alemania, Barcelona, España. Distribuido por: Boehringer Ingelheim Promeco S.A. de C.V., Calle del Maíz No. 49, Barrio Xaltocan, Xochimilco,16090 México, D.F. ® Marca registrada.
Número de registro del medicamento: 099M97 SSA IV.
Clave de IPPA: KEAR-05330020510430/RM2005
MOBICOX®
BOEHRINGER PM
Suspensión
Denominación genérica: Meloxicam.
Forma farmacéutica y formulación: Suspensión. Cada 100 ml contienen: meloxicam 150 mg. Excipiente c.b.p. 100 ml.
Indicaciones terapéuticas: MOBICOX® es un antiinflamatorio no esteroideo, indicado para el tratamiento sintomático inicial y a corto plazo de la artritis reumatoide, osteoartritis dolorosa, (artrosis, enfermedad articular degenerativa) y la espondilitis anquilosante de la periartritis de hombro y cadera, así como de las distensiones musculares y de los ataques de gota. Util para el tratamiento de la inflamación y del dolor secundario a traumatismos, así como de los procesos inflamatorios de tejidos blandos (vías aéreas), padecimientos ginecológicos, dismenorrea primaria.
Farmacocinética y farmacodinamia: Farmacocinética: absorción: meloxicam, principio activo de MOBICOX®, es bien absorbido en el tracto gastrointestinal, lo cual se refleja en la alta biodisponibilidad absoluta cercana al 89% después de su administración oral. Se ha demostrado su bioequivalencia para todas las formas farmacéuticas en las que el medicamento está disponible. Después de la administración de meloxicam, las concentraciones máximas promedio son alcanzadas dentro de las 2 horas después de la administración de suspensión. El estado estable es alcanzado entre los 3 y 5 días con un régimen de dosificación múltiple. Con la dosificación de una vez al día, se alcanzan concentraciones plasmáticas pico con pequeñas fluctuaciones que van del rango de 0,4-1,0 mcg/ml para la dosis de 7,5 mg y de 0,8-2,0 mcg/ml para la dosificación de 15 mg, respectivamente (Cmín y Cmáx en estado estable, respectivamente). La concentración plasmática máxima de meloxicam en estado estable fue obtenida entre cinco y seis horasposteriores a la administración de la suspensión. El tratamiento continuo por períodos largos (seis meses) no mostró ningún cambio en la farmacocinética comparada con la farmacocinética en estado estable después de dos semanas de tratamiento oral conmeloxicam de 15 mg al día. Cualquier diferencia después del tratamiento mayor de seis meses es improbable. La absorción de meloxicam no es alterada por el consumo concomitante de alimentos. Distribución: el meloxicam se une fuertemente a las proteínas plasmáticas, esencialmente a la albúmina (99%). Penetra en el líquido sinovial alcanzando concentraciones hasta de un 50% de las encontradas en el plasma. El volumen de distribución es bajo, en promedio 11 l. La variación interindividual es en el orden de 30 a 40%. Biotransformación: el meloxicam sufre una extensa biotransformación hepática; cuatro diferentes metabolitos de meloxicam fueron identificados en orina, de los cuales todos son farmacológicamente inactivos. El principal es el 5'carboximeloxicam (60% de la dosis), mismo que se forma de la oxidación de un metabolito intermedio, el 5'hidroximetilmeloxicam, que es excretado en forma menos extensa (9% de la dosis). Los estudios in vitro sugieren que el CYP 2C9 juega un papel importante dentro de esta ruta metabólica, con una contribución menor de la isoenzima CYP 3A4. La actividad de la peroxidasa del paciente es probablemente responsable de la formación de los otros dos metabolitos, los cuales corresponden al 16 y al 4% de la dosis administrada, respectivamente. Eliminación: la excreción del meloxicam se realiza predominantemente en forma de metabolitos y ocurre en cantidades iguales tanto en las heces como en la orina. Menos del 5% de la dosis diaria administrada se elimina sin modificar en las heces, mientras que solo trazas del compuesto original son encontradas en la orina. El meloxicam presenta una vida media de 20 horas aproximadamente. El aclaramiento plasmático es de 8 ml/min. Linealidad: el meloxicam demostró una farmacocinética lineal en el rango de dosis de 7,5 mg a 15 mg después de laadministración oral. Poblaciones especiales: insuficiencia hepática y renal: ni la insuficiencia renal ni la hepática leve o modera presentan efectos sustanciales sobre la farmacocinética del meloxicam. En la insuficiencia renal terminal, el incremento en el volumen de distribución puede dar como resultado mayores concentraciones de principio activo no unido a las proteínas, por lo que en estos casos no deberá excederse de una dosis diaria de 7,5 mg. Ancianos: el aclaramiento plasmático fue ligeramente menor en los ancianos en comparación con lo reportado en sujetos jóvenes. Se realizó un estudio en 36 niños, en donde fueron medidos los parámetros farmacocinéticos en 18 niños con dosis de 0,25 mg/kg de peso corporal. Obteniéndose una concentración plasmática máxima Cmáx (-34%) y con AUC0-∞ (-28%), tendiendo a ser más bajo en el grupo de edad más joven (edad entre 2 a 6 años, n=7) comparado con el otro grupo de edad mayor (7 a 14 años, n=11), por lo que el aclaramiento parece ser más alto en el grupo de edad más joven. Una comparación histórica con adultos revela que las concentraciones plasmáticas fueron por lo menos similares para el grupo de edad mayor en niños y en adultos. La vida media deeliminación (13 h) fue similar en ambos grupos, con tendencia a ser menor que en los adultos (15-20 h). Farmacodinamia: el meloxicam, principio activo de MOBICOX®, es un antiinflamatorio no esteroideo (AINE) del grupo del ácido enólico, el cual ha mostrado poseer propiedades antiinflamatoria, analgésica y antipirética. El meloxicam ha mostrado una potente actividad antiinflamatoria en todos los modelos estándar de inflamación. Un mecanismo común para los efectos anteriores se deriva de la capacidad del meloxicam de inhibir la biosíntesis de prostaglandinas, conocidas como sustancias mediadoras de la inflamación. La comparación de la dosis ulcerogénica y la dosis antiinflamatoria efectiva en un modelo de artritis en ratas confirmó un margen terapéutico superior sobre otros AINEs. In vivo, meloxicam inhibe la biosíntesis de las prostaglandinas, mediadores químicos de la inflamación, en forma más potente en el sitio de la inflamación que en la mucosa gástrica o en el riñón. Se considera que la inhibición de la COX-2 genera el efecto terapéutico de los AINEs, en tanto que la inhibición de la COX-1 puede ser responsable de las reacciones adversas a nivel gástrico y renal. La selectividad de COX-2 de meloxicam se ha confirmado tanto in vitro así como ex vivo en un número de sistemas de análisis. En el ensayo en sangre pura humana, el meloxicam ha mostrado, in vitro, inhibir selectivamente a la COX-2. El meloxicam demostró (7,5 mg y 15 mg) una mayor inhibición de COX-2 ex vivo, como se demostró por una mayor inhibición de la producción de PGE2 estimulada por el lipopolisácaridos (COX-2) cuando se comparó con la producción de tromboxano en la coagulación de la sangre (COX-1). Estos efectos fueron dependientes de la dosis. El meloxicam demostró no tener efecto en la agregación plaquetaria o en el tiempo de sangrado en dosis recomendadas ex vivo, mientras que la indometacina, diclofenaco, ibuprofeno y naproxeno inhiben significativamente la agregación plaquetaria y prolongan el sangrado. En los estudios clínicos, los eventos adversos gastrointestinales fueron reportados menos frecuentemente con meloxicam 7,5 mg y 15 mg que con otros AINEs con los cuales fue comparado, debido principalmente a la baja incidencia de eventos tales como la dispepsia, vómito, náusea y dolor abdominal. La incidencia de perforación gastrointestinal superior, úlceras y sangrado reportada y atribuida a meloxicam es baja y dependiente de la dosis. No existe un estudio conducido adecuadamente para detectar diferencias estadísticas en la incidencia de perforación del tracto gastrointestinal superior, obstrucción o sangrado entre meloxicam y otro AINEs.Se hizo un análisis involucrando a pacientes tratados con meloxicam en 35 estudios clínicos con diagnóstico de osteoartritis, artritis reumatoide y espondilitis anquilosante. La exposición al meloxicam en estos estudios abarcó periodos de tres semanas hasta un año (la mayoría fueron enrolados en los estudios a un mes). Casi todos los pacientes que participaron en estos estudios tenían antecedentes de perforaciones gastrointestinales, úlceras y sangrado. La incidencia de perforación gastrointestinal superior, obstrucción o sangrado con significancia clínica fue analizada retrospectivamente siguiendo de forma ciega e independiente en cada caso. Los resultados se muestran en la siguiente tabla:
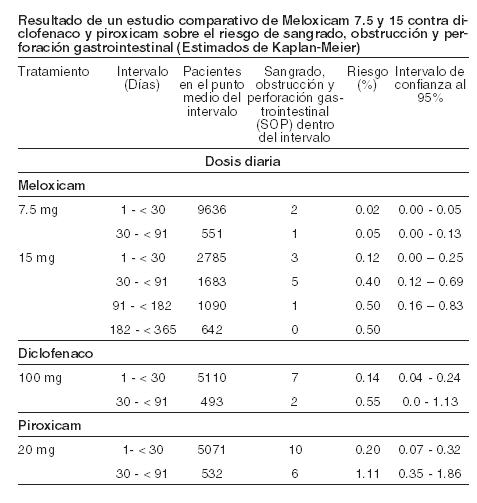
En un estudio doble ciego randomizado en niños con artritis reumatoide juvenil en edades de 2 a 16 años, la suspensión oral de meloxicam tomada una vez al día en dosis de 0,125 mg-kg de peso corporal (N=73) y 0,25 mg-kg de peso corporal (N=74) fue comparado con naproxeno 10 mg-kg/día (N=78). La tasa de respuesta después de un año de tratamiento fue 77%, 76% y 74% y estos son comparables entre los 3 grupos de tratamiento. La incidencia de eventos adversos fue 74%, 80% y 85%, respectivamente.
Contraindicaciones: Hipersensibilidad conocida al principio activo o a los componentes de la fórmula. Existe un riesgo potencial de sensibilidad cruzada con el ácido acetilsalicílico y otros antiinflamatorios no esteroideos, por lo que no debe ser utilizado en pacientes en los que la administración previa de dichos fármacos haya dado lugar a manifestaciones de asma, angioedema, pólipos nasales o urticaria seguida de la administración de ácido acetilsalicílico u otros AINEs. Tampoco deberá emplearse en los siguientes casos: ulceración/perforación activa o reciente de origen gastrointestinal. Enfermedad intestinal inflamatoria activa (enf. de Crohn o colitis ulcerativa). Insuficiencia hepática severa. Insuficiencia renal severa no dializada. Sangrado gastrointestinal patente, sangrado cerebrovascular reciente o trastornos hemorrágicos sistémicos ya establecidos. Falla cardíaca no controlada o severa. Embarazo o lactancia. MOBICOX® está contraindicado para el tratamiento de dolor perioperatorio secundario a la colocación de bypass coronario. MOBICOX® Suspensión está contraindicado en casos en donde existan condiciones hereditarias raras que puedan ser incompatibles con el excipiente del producto.
Precauciones generales: Al igual que con otros AINEs, se debe tener precaución especial al tratar a pacientes con antecedentes de enfermedad gastrointestinal, o que se encuentren bajo tratamiento con anticoagulantes. Los pacientes con presencia de síntomas gastrointestinales deben ser vigilados. Si llegara a presentarse úlcera péptica o sangrado gastrointestinal, el medicamento deberá suspenderse. Pueden llegar a suceder sangrados gastrointestinales, ulceraciones o perforaciones potencialmente fatales en cualquier momento durante el tratamiento con o sin síntomas de alarma o antecedentes de alteraciones gastrointestinales serias. Las consecuencias de tales eventos son generalmente más serias en pacientes de edad avanzada. Pueden presentarse reacciones en la piel severas, algunas de ellas fatales, incluyendo dermatitis exfoliativa, síndrome de Stevens-Johnson y necrolisis tóxica epidérmica, las cuales han sido reportadas muy raramente en asociación con el uso de antiinflamatorios no esteroideos. En los pacientes con alto riesgo de presentar este tipo de reacciones, en la mayoría de los casos aparecen en el primer mes de tratamiento. MOBICOX® deberá suspenderse si aparece rash, lesiones en mucosas o cualquier otro signo de hipersensibilidad. Los AINEs pueden incrementar el riesgo de aparición de eventos trombóticos cardiovasculares serios, infarto al miocardio y accidentes cerebrovasculares agudos, los cuales pueden ser fatales. El riesgo aumenta cuando el tiempo de administración es prolongado. El riesgo se aumenta en pacientes con enfermedad cerebrovascular o factores de riesgo para enfermedad cardiovascular. Los AINEs inhiben la síntesis de prostaglandinas renales, las cuales juegan un rol de apoyo en el mantenimiento de la perfusión renal. En los pacientes cuyo flujo sanguíneo renal o vo
lumen sanguíneo se encuentre disminuido, la administración de un AINE puede precipitar una evidente descompensación renal, la cual es típicamente seguida del retorno al estado anterior al tratamiento tras la suspensión de la terapia antiinflamatoria no esteroidea. Los pacientes que presentan un mayor riesgo de tales reacciones son los pacientes ancianos, deshidratados, con insuficiencia cardíaca congestiva, cirrosis hepática, síndrome nefrótico y una evidente enfermedad renal, aquellos que hayan recibido un diurético, inhibidores IECA o antagonistas del receptor de angiotensina II o aquellos que se les haya practicado una intervención quirúrgica mayor y que hayan presentado hipovolemia. En estos pacientes, el volumen de diuresis y la función renal deben ser cuidadosamente monitorizados desde el inicio del tratamiento. En raras ocasiones los AINEs pueden generar nefritis intersticial, glomérulonefritis, necrosis medular renal o síndrome nefrótico. La dosificación de MOBICOX® en pacientes con insuficiencia renal terminal con hemodiálisis no debe ser mayor de 7,5 mg. No es necesario disminuir la dosificación en pacientes con insuficiencia renal de leve a moderada (p.ej., en pacientes con una depuración de creatinina mayor de 25 ml/min). Tal como sucede con la mayoría de los AINEs, se han reportado elevaciones ocasionales de las transaminasas séricas o de otros parámetros de la función hepática. En la mayoría de los casos, éstas han sido pequeñas, pasajeras, superiores y cercanas a los límites normales superiores. Si tales alteraciones fueran significativas o persistieran, MOBICOX® debe ser discontinuado y deberán realizarse los exámenes correspondientes. No son necesarias las reducciones de la dosificación en pacientes con cirrosis hepática clínicamente estable. Los pacientes debilitados o frágiles generalmente toleran los eventos adversos en menor medida, por lo que deben ser vigilados cuidadosamente. Como sucede con otros AINEs deben tomarse precauciones especiales en pacientes de edad avanzada que son más propensos de presentar insuficiencia renal, hepática o cardiaca. La inducción de la retención de sodio, potasio y de líquidos, así como la interferencia con los efectos natriuréticos de los diuréticos pueden ser exacerbadas tras la administración de AINEs. Como resultado, pueden precipitarse o exacerbarse tanto la insuficiencia cardiaca como la hipertensión arterial en pacientes susceptibles, por lo que en pacientes con este riesgo se recomienda su vigilancia continua. Como cualquier otro AINEs MOBICOX® puede enmascarar síntomas de una enfermedad infecciosa subyacente. El uso del meloxicam, al igual que con cualquier fármaco que inhiba la síntesis de ciclooxigenasas/prostaglandinas, puede interferir con la fertilidad por lo que no se recomienda en mujeres que pretendan concebir. Por lo tanto, se debe considerar la interrupción de meloxicam en mujeres con dificultad para concebir, o en aquellas que se encuentran bajo investigación de infertilidad. No existen estudios específicos acerca de los efectos sobre la capacidad para conducir vehículos o el uso de maquinaria. Los pacientes que experimenten alteraciones visuales, mareos u otros trastornos del sistema nervioso central deberán abstenerse de tales actividades. MOBICOX® suspensión contiene 3,5 g de sorbitol por dosis máxima diaria recomendada. Pacientes con problemas hereditarios raros de intolerancia a la fructosa no deberán tomar meloxicam.
Restricciones de uso durante el embarazo y la lactancia: MOBICOX® está contraindicado durante el embarazo y la lactancia. La inhibición de la síntesis de prostaglandinas puede afectar adversamente el curso del embarazo y/o el desarrollo embrio-fetal. Datos de estudios epidemiológicos sugieren un incremento del riesgo aumentado de aborto, de malformaciones cardíacas y gastrosquisis posterior al uso de inhibidores de la síntesis de prostaglandinas en etapas tempranas del embarazo. El riesgo absoluto para malformación cardiovascular se aumentó de menos de 1% hasta aproximadamente 1,5%, por lo que el riesgo aumenta en relación con la dosis y el tiempo de duración de la terapia. En animales, la administración de inhibidores de la síntesis de prostaglandinas ha dado como resultado un incremento en la mortalidad fetal. Agregado a esto, existe un incremento en la incidencia de varias malformaciones, incluyendo cardiovasculares, las cuales han sido reportadas en estudios hechos en animales a los cuales se les administró inhibidores de la síntesis de prostaglandinas durante el periodo organogénico. Durante el tercer trimestre del embarazo, todos los inhibidores de la síntesis de prostaglandinas pueden exponer al feto a: toxicidad cardiopulmonar (con cierre prematuro del conducto arterioso e hipertensión pulmonar). Disfunción renal, que puede progresar a falla renal con oligohidramnios. La madre y el neonato, en el final del embarazo: posibilidad de prolongación del tiempo de sangrado, los efectos antiagregantes pueden ocurrir inclusive con dosis bajas. Alargamiento del tiempo de labor, secundario a inhibición de las contracciones uterinas. No existe ninguna experiencia específica con MOBICOX®, pero se sabe que los AINEs son fármacos que son excretados por leche materna, por lo que su administración está contraindicada en mujeres que se encuentran en periodo de lactancia.
Reacciones secundarias y adversas: Los siguientes eventos adversos, que pueden tener causa relacionada con la administración de MOBICOX®, han sido reportados. Los eventos adversos que pueden estar causalmente relacionados a la administración demeloxicam han resultado de los reportes relacionados con la administración del medicamento comercializado rastreado por su número de referencia: alteraciones de la sangre y sistema linfático: cuenta sanguínea anormal (incluyendo cuenta diferencial de células blancas), leucopenia, trombocitomenia y anemia. La administración concomitante con medicamentos potencialmente mielotóxicos, en particular metrotexate, parece ser un factor predisponente de citopenia. Alteraciones del sistema inmune: reacciones anafilácticas, reacciones anafilactoides y otras reacciones de hipersensibilidad inmediata. Alteraciones psiquiátricas: estado confusional, desorientación, alteración del estado de ánimo. Alteraciones del sistema nervioso: mareo, somnolencia y cefalea. Alteraciones oculares: alteraciones en la visión incluyendo visión borrosa, conjuntivitis. Alteraciones del oído y laberinto: vértigo, tinitus. Alteraciones cardiacas: palpitaciones. Alteraciones vasculares: incremento en la presión sanguínea, ruborización. Alteraciones respiratorias, torácicas y mediastinales: asma en individuos alérgicos a la aspirina u otros AINEs. Alteraciones gastrointestinales: perforación gastrointestinal, hemorragia gastrointestinal oculta o macroscópica. Ulcera gastroduodenal, colitis, gastritis, esofagitis, estomatitis, dolor abdominal, dispepsia, diarrea, nausea, vómito, constipación, flatulencia, singultos. La hemorragia gastrointestinal, la ulceración o perforación pueden ser potencialmente fatales. Alteraciones hepatobiliares: hepatitis, pruebas de función hepática anormales (p. ej. aumento en las transaminasas o bilirrubina). Alteraciones de la piel y tejido celular subcutáneo: necrólisis epidérmidermica tóxica, síndrome de Stevens-Johnson, angioedema, dermatitis bulosa, eritema multiforme, rash, urticaria, reacción de fotosensibilidad y prurito. Alteraciones renales y urinarias: falla renal aguda, pruebas de función renal anormales (aumento de creatinina sérica y/o urea sérica. El uso de AINEs puede estar relacionado con alteraciones en la micción, incluyendo retención urinaria aguda. Alteraciones generales: edema.
Interacciones medicamentosas y de otro género: Otros inhibidores de la síntesis de prostaglandinas, incluyendo glucocorticoides y salicilatos (ácido acetilsalicílico) en coadministración con inhibidores de la síntesis de prostaglandinas pueden incrementar el riesgo de úlcera y sangrado gastrointestinal por efecto sinérgico, por lo que no se recomienda su combinación. La administración concomitante de aspirina (1000 mg tres veces al día) a voluntarios sanos tendió a aumentar el área bajo la curva (10%) y la concentración máxima en plasma (24%) de meloxicam. Se desconoce la importancia clínica de esta interacción. Sufonato sódico de poliestireno: puede existir un riesgo de necrosis colónica (posiblemente fatal) con la administración conjunta, debido a la presencia de sorbitol en meloxicam suspensión oral. Anticoagulantes orales; ticlopidina, heparina administrada por vía sistémica, trombolíticos e inhibidores selectivos de la recaptura de serotonina, los cuales aumentan el riesgo de sangrado. Si tales prescripciones no pueden ser evitadas, se deben vigilar estrechamente los efectos de dichos anticoagulantes. Litio: la administración de AINEs se ha asociado al incremento de los niveles séricos de litio (por medio de una disminución de la excreción renal de litio), lo cual puede originar valores tóxicos. No se recomienda el uso concomitante de litio y AINEs. Si esta combinación es necesaria, se deben monitorear cuidadosamente las concentraciones de litio en plasma durante el inicio, ajuste e interrupción del tratamiento con meloxicam. Metotrexato: los AINEs pueden reducir la secreción tubular del metotrexato aumentando así la concentración de éste en plasma. Por esta razón, no se recomienda el uso concomitante de AINEs en pacientes con altas dosis de metotrexato (más de 15 mg/semana). El riesgo de interacción entre AINEs y el metotrexato se debe considerar también en pacientes con dosis baja de metotrexato, especialmente en pacientes con función renal alterada. En caso de ser necesaria la terapia concomitante, se debe monitorizar el conteo de glóbulos rojos en sangre y la función renal. Se debe tener cuidado en caso de que se administren concomitantemente el AINE y el metotrexato durante 3 días, en cuyo caso el nivel en plasma del metotrexato se puede incrementar y provocar con ello un aumento de la toxicidad. Aunque la farmacocinética del metotrexato (15 mg/semana) no se afectó en forma relevante por el tratamiento concomitante con el meloxicam, se debe considerar que la toxicidad hematológica del metotrexato se puede incrementar al administrarse de forma concomitante con AINEs. Anticonceptivos: con el uso de AINEs se ha reportado un descenso de la eficacia de dispositivos intrauterinos, pero se requiere de mayor información. Diuréticos: en pacientes deshidratados, el tratamiento con AINEs se ha asociado con un riesgo potencial de insuficiencia renal aguda. Los pacientes a los cuales se les administre MOBICOX® conjuntamente con un diurético deben ser adecuadamente hidratados y vigilados acerca de su función renal antes de iniciar el tratamiento. Antihipertensivos (ej. beta-bloqueadores, inhibidores de la ECA, vasodilatadores y diuréticos): se ha reportado una disminución en el efecto de los antihipertensivos debido a la inhibición de las prostaglandinas vasodilatadoras durante el tratamiento con AINEs. Los AINEs y los antagonistas de los receptores de angiotesina II así como los inhibidores ECA ejercen un efecto sinérgico en la disminución de la filtración glomerular. En pacientes con falla renal preexistente esto puede conducir a insuficiencia renal aguda. La colestiramina unida al meloxicam en el tracto gastrointestinal favorece su eliminación. La nefrotoxicidad de la ciclosporina puede intensificarse por el uso de AINEs debido a los efectos sobre las prostaglandinas en la vía renal. Durante el tratamiento combinado, se debe de vigilar la función renal. El meloxicam es eliminado casi totalmente por el metabolismo hepático del cual aproximadamente dos terceras partes se encuentran mediadas por las enzimas del citocromo (CYP) P450 (vía primaria CYP 2C9 y vía secundaria CYP 3A4) y una tercera parte por otras vías tales como la oxidación por la peroxidasa. El potencial de una interacción farmacocinética debe de tomarse en cuenta cuando el meloxicam y fármacos conocidos que pudieran inhibir o sean metabolizados por el CYP 2C9 y/o CYP 3A4 sean administrados concomitantemente. No se han detectado interacciones farmacocinéticas relevantes fármaco-fármaco con respecto a la administración concomitante de antiácidos, cimetidina, digoxina y furosemida. Las interacciones con hipoglucemiantes no pueden ser excluidas.
Alteraciones en los resultados de pruebas de laboratorio: Al igual que con otros AINEs, ocasionalmente pueden presentarse elevaciones de las transaminasas séricas o de otros indicadores de la función hepática. En la mayoría de los casos, estas elevaciones han sido discretas y transitorias y han remitido sin necesidad de interrumpir la medicación. Si esta anomalía llegara a ser significativa o persistente, deberá suspenderse la administración del medicamento y deberán practicarse los estudios indicados para el caso.
Precauciones en relación con efectos de carcinogénesis, mutagénesis, teratogénesis y sobre la fertilidad: Un extenso programa de toxicología demostró que meloxicam tiene un perfil de seguridad aceptable. A pesar de que no se observaron efectos teratogénicos en los estudios preclínicos, no se debe utilizar MOBICOX® en el embarazo y la lactancia. Los estudios de carcinogenicidad no mostraron evidencia de actividad oncogénica, no se han encontrado alteraciones sobre la fertilidad. Las dosis de 2.5 mg/kg en ratas y 20 mg/kg en conejos o mayores fueron embriotóxicas. Meloxicam no fue mutagénico en el estudio de AMES. En los estudios realizados meloxicam fue condro-neutral, es decir, no dañó el cartílago articular durante la exposición a largo plazo. Meloxicam no indujo reacciones inmunogénicas en ratones y cobayos.
Dosis y vía de administración: Vía de administración: oral. A continuación, se indican los esquemas de dosificación para cada uno de los siguientes padecimientos: osteoartritis: dosis de 7,5 mg/día (5 ml), y si es necesario, se puede incrementar a 15 mg/día (10 ml). Artritis reumatoide: dosis de 15 mg/día (10 ml) y, de acuerdo con la respuesta terapéutica, la dosis se puede reducir a 7,5 mg/día (5 ml). Espondilitis anquilosante: dosis de 15 mg/día y de acuerdo a la respuesta terapéutica la dosis puede ser reducida a 7,5mg/día. En pacientes con riesgo elevado de reacciones adversas, iniciar tratamiento con dosis de 7.5mg al día. En pacientes en diálisis con insuficiencia renal grave, la dosis no deberá exceder de 7,5 mg al día. El riesgo potencial de la presentación de reacciones adversas incrementa con la dosis y con el tiempo de exposición, por lo que se recomienda su uso por periodos cortos con las dosis efectivas mínimas posibles. Adolescentes: la dosis máxima recomendada en este grupo es de 0,25 mg/kg. Su uso en general debe ser restringido a niños de 12 años en adelante y adultos, excepto cuando se apruebe su uso para artritis reumatoide juvenil. La dosis diaria máxima recomendada de MOBICOX® es de 15 mg. La dosis diaria total debe ser ingerida en una sola toma junto con alimentos. La dosis diaria total de MOBICOX®, incluso combinando diferentes formas farmacéuticas no deberá exceder los 15 mg.
Manifestaciones y manejo de la sobredosificación o ingesta accidental: En caso de sobredosificación o de ingesta accidental, se recomienda vaciamiento gástrico y medidas generales de soporte. No se conoce ningún antídoto específico. En un estudio clínico, se observó que la colestiramina acelera la eliminación del meloxicam.
Presentación(es): Frasco con 40, 60 y 100 ml con pipeta dosificadora o vaso.
Recomendaciones sobre almacenamiento: Consérvese el frasco bien tapado a temperatura ambiente a no más de 30°C.
Leyendas de protección: Literatura exclusiva para médicos. Léase instructivo anexo. Dosis: la que el médico señale. Su venta requiere receta médica. No se deje al alcance de los niños. No se use en el embarazo, lactancia ni en niños menores de 12 años.
Nombre y domicilio del laboratorio: Hecho en México por: Boehringer Ingelheim Promeco S.A. de C.V., Calle del Maíz No. 49, Barrio Xaltocan, Xochimilco, 16090, México, D.F. ® Marca registrada.
Número de registro del medicamento: 360M2001 SSA IV.
MOBICOX®
BOEHRINGER PM
Tabletas
Denominación genérica: Meloxicam.
Forma farmacéutica y formulación: Tabletas. Cada tableta contiene: meloxicam 7,5 mg y 15 mg. Excipiente cbp 1 tableta.
Indicaciones terapéuticas: MOBICOX® es un antiinflamatorio no esteroideo, indicado para el tratamiento sintomático inicial y a corto plazo de la artritis reumatoide, osteoartritis dolorosa (artrosis, enfermedad articular degenerativa) y la espondilitis anquilosante, de la periatritis de hombro y cadera, así como de las distensiones musculares y de los ataques de gota. Util para el tratamiento de la inflamación y del dolor secundario a traumatismos, así como de los procesos inflamatorios de tejidos blandos (vías aéreas), padecimientos ginecológicos, dismenorrea primaria.
Farmacocinética y farmacodinamia: Farmacocinética: absorción: meloxicam, principio activo de MOBICOX® es bien absorbido en el tracto gastrointestinal, lo cual se refleja en la alta biodisponibilidad absoluta cercana al 89% después de su administración oral. Se ha demostrado su bioequivalencia para todas las formas farmacéuticas en las que el medicamento está disponible. Después de la administración de meloxicam, las concentraciones máximas promedio son alcanzadas entre las 5-6 horas de una administración única. El estado estable es alcanzado entre los 3 y 5 días con un régimen de dosificación múltiple. Con la dosificación de una vez al día, se alcanzan concentraciones plasmáticas pico con pequeñas fluctuaciones que van del rango de 0,4-1,0 mcg/ml para la dosis de 7,5 mg y de 0,8-2,0 mcg/ml para la dosificación de 15 mg, respectivamente (Cmín y Cmáx en estado estable, respectivamente). La concentración plasmática máxima de meloxicam en estado estable fue obtenida entre cinco y seis horas posteriores a la administración de la tableta. El tratamiento continuo por períodos largos (seis meses) no mostró ningún cambio en la farmacocinética comparada con la farmacocinética en estado estable después de dos semanas de tratamiento oral con meloxicam de 15mg al día. Cualquier diferencia después del tratamiento mayor de seis meses es improbable. La absorción de meloxicam no es alterada por el consumo concomitante de alimentos. Distribución: el meloxicam se une fuertemente a las proteínas plasmáticas, esencialmente a la albúmina (99%). Penetra en el líquido sinovial alcanzando concentraciones hasta de un 50% de las encontradas en el plasma. El volumen de distribución es bajo, en promedio 11 l. La variación interindividual es en el orden de 30 a 40%. Biotransformación: el meloxicam sufre una extensa biotransformación hepática, cuatro diferentes metabolitos de meloxicam fueron identificados en orina, de los cuales todos son farmacológicamente inactivos. El principal es el 5´-carboximeloxicam (60% de la dosis), mismo que se forma de la oxidación de un metabolito intermedio, el 5´-hidroximetilmeloxicam, que es excretado en forma menos extensa (9% de la dosis). Los estudios in vitro sugieren que el CYP 2C9 juega un papel importante dentro de esta ruta metabólica, con una contribución menor de la isoenzima CYP 3A4. La actividad de la peroxidasa del paciente es probablemente responsable de la formación de los otros dos metabolitos, los cuales corresponden al 16 y al 4% de la dosis administrada, respectivamente. Eliminación: la excreción del meloxicam se realiza predominantemente en forma de metabolitos y ocurre en cantidades iguales tanto en las heces como en la orina. Menos del 5% de la dosis diaria administrada se elimina sin modificar en las heces, mientras que sólo trazas del compuesto original son encontradas en la orina. El meloxicam presenta una vida media de 20 horas aproximadamente. El aclaramiento plasmático es de 8 ml/min. Linearidad: el meloxicam demostró una farmacocinética lineal en el rango de dosis de 7,5 mg a 15 mg después de la administración oral. Poblaciones especiales: insuficiencia hepática y renal: ni la insuficiencia renal, ni la hepática leve o modera presentan efectos sustanciales sobre la farmacocinética del meloxicam. En la insuficiencia renal terminal, el incremento en el volumen de distribución puede dar como resultado mayores concentraciones de principio activo no unido a las proteínas, por lo que en estos casos no deberá excederse de una dosis diaria de 7,5 mg. Ancianos: el aclaramiento plasmático fue ligeramente menor en los ancianos en comparación con lo reportado en sujetos jóvenes. Se realizó un estudio en 36 niños, en donde fueron medidos los parámetros farmacocinéticos en 18 niños con dosis de 0,25mg/kg de peso corporal. Obteniéndose una concentración plasmática máxima Cmáx (-34%) y con AUC0-∞ (-28%), tendiendo a ser más bajo en el grupo de edad más joven (edad entre 2 a 6 años, n=7) comparado con el otro grupo de edad mayor (7 a 14 años, n=11) por lo que el aclaramiento parece ser más alto en el grupo de edad más joven. Una comparación histórica con adultos, revela que las concentraciones plasmáticas fueron casi similares para el grupo de edad mayor en niños y en adultos. La vida media de eliminación (13 h) fue similar en ambos grupos con tendencia a ser menor que en los adultos (15-20 h). Farmacodinamia: el meloxicam, principio activo de MOBICOX® es un antiinflamatorio no esteroideo (AINE) del grupo del ácido enólico, el cual ha mostrado poseer propiedades antiinflamatoria, analgésica y antipirética. El meloxicam ha mostrado una potente actividad antiinflamatoria en todos los modelos estándar de inflamación. Un mecanismo común para los efectos anteriores se deriva de la capacidad del meloxicam de inhibir la biosíntesis de prostaglandinas, conocidas como sustancias mediadoras de la inflamación. La comparación de la dosis ulcerogénica y la dosis antiinflamatoria efectiva en un modelo de artritis en ratas confirmó un margen terapéutico superior sobre otros AINEs. In vivo, meloxicam inhibe la biosíntesis de las prostaglandinas, mediadores químicos de la inflamación, en forma más potente en el sitio de la inflamación que en la mucosa gástrica o en el riñón. Se considera que la inhibición de la COX-2 genera el efecto terapéutico de los AINEs en tanto que la inhibición de la COX-1 puede ser responsable de las reacciones adversas a nivel gástrico y renal. La selectividad de COX-2 de meloxicam se ha confirmado tanto in vitro así como ex vivo en un número de sistemas de análisis. En el ensayo en sangre pura humana, el meloxicam ha mostrado, in vitro, inhibir selectivamente a la COX-2. El meloxicam demostró (7,5 mg y 15 mg) una mayor inhibición de COX-2 ex vivo, como se demostró por una mayor inhibición de la producción de PGE2 estimulada por el lipopolisácaridos (COX-2) cuando se comparó con la producción de tromboxano en la coagulación de la sangre (COX-1). Estos efectos fueron dependientes de la dosis. El meloxicam demostró no tener efecto en la agregación plaquetaria o en el tiempo de sangrado en dosis recomendadas ex vivo, mientras que la indometacina, diclofenaco, ibuprofeno y naproxeno inhiben significativamente la agregación plaquetaria y prolongan el sangrado. En los estudios clínicos, los eventos adversos gastrointestinales fueron reportados menos frecuentemente con meloxicam 7,5 mg y 15 mg que con otros AINEs con los cuales fue comparado, debido principalmente a la baja incidencia de eventos tales como la dispepsia, vómito, náusea y dolor abdominal. La incidencia de perforación gastrointestinal superior, úlceras y sangrado reportados y atribuidos a meloxicam es baja y dependiente de la dosis. No existe un estudio conducido adecuadamente para detectar diferencias estadísticas en la incidencia de perforación del tracto gastrointestinal superior, obstrucción o sangrado entre meloxicam y otro AINEs. Se hizo un análisis involucrando a pacientes tratados con meloxicam en 35 estudios clínicos con diagnóstico de osteoartritis, artritis reumatoide y espondilitis anquilosante. La exposición al meloxicam en estos estudios abarcó períodos de tres semanas hasta un año (la mayoría fueron enrolados en los estudios a un mes). Casi todos los pacientes que participaron en estos estudios tenían antecedentes de perforaciones gastrointestinales, úlceras y sangrado. La incidencia de perforación gastrointestinal superior, obstrucción o sangrado con significancia clínica fue analizada retrospectivamente siguiendo de forma ciega e independiente en cada caso. Los resultados se muestran en la siguiente tabla:
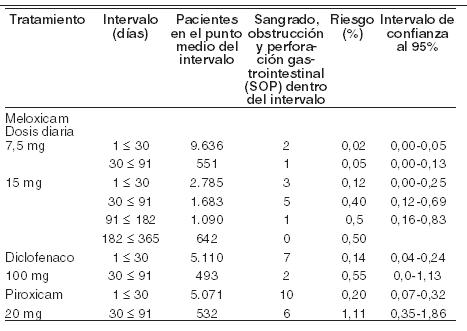
Contraindicaciones: Hipersensibilidad conocida al principio activo o a los componentes de la fórmula. Existe un riesgo potencial de sensibilidad cruzada con el ácido acetilsalicílico y otros antiinflamatorios no esteroideos, por lo que no debe ser utilizado en pacientes en los que la administración previa de dichos fármacos haya dado lugar a manifestaciones de asma, angioedema, pólipos nasales o urticaria seguida de la administración de ácido acetilsalicílico u otros AINEs. Tampoco deberá emplearse en los siguientes casos: ulceración/perforación activa o reciente de origen gastrointestinal. Enfermedad intestinal inflamatoria activa (enf. de Crohn o colitis ulcerativa). Insuficiencia hepática severa. Insuficiencia renal severa no dializada. Sangrado gastrointestinal patente, sangrado cerebrovascular reciente o trastornos hemorrágicos sistémicos ya establecidos. Falla cardíaca no controlada o severa. Niños menores de 12 años, excepto cuando su uso se ha aprobado en artritis reumatoide juvenil. Embarazo o lactancia. MOBICOX® está contraindicado para el tratamiento de dolor perioperatorio secundario a la colocación de by pass coronario. MOBICOX® Tabletas está contraindicado en casos en donde existan condiciones hereditarias raras que puedan ser incompatibles con el excipiente del producto.
Precauciones generales: Al igual que con otros AINEs, se debe tener precaución especial al tratar a pacientes con antecedentes de enfermedad gastrointestinal, o que se encuentren bajo tratamiento con anticoagulantes. Los pacientes con presencia de síntomas gastrointestinales deben ser vigilados. Si llegara a presentarse úlcera péptica o sangrado gastrointestinal, el medicamento deberá suspenderse. Pueden llegar a suceder sangrados gastrointestinales, ulceraciones o perforaciones en cualquier momento durante el tratamiento con o sin síntomas de alarma o antecedentes de alteraciones gastrointestinales serias. Las consecuencias de tales eventos son generalmente más serias en pacientes de edad avanzada. Pueden presentarse reacciones en la piel severas, algunas de ellas fatales, incluyendo dermatitis exfoliativa, Síndrome de Stevens-Johnson y necrólisis tóxica epidérmica, las cuales han sido reportadas muy raramente en asociación con el uso de antiinflamatorios no esteroideos. En los pacientes con alto riesgo de presentar este tipo de reacciones en la mayoría de los casos aparecen en el primer mes de tratamiento. MOBICOX® deberá suspenderse si aparece rash, lesiones en mucosas o cualquier otro signo de hipersensibilidad. Los AINEs pueden incrementar el riesgo de aparición de eventos trombóticos cardiovasculares serios, infarto al miocardio y accidentes cerebrovasculares agudos, los cuales pueden ser fatales. El riesgo aumenta cuando el tiempo de administración es prolongado. El riesgo se aumenta en pacientes con enfermedad cerebrovascular o factores de riesgo para enfermedad cardiovascular. Los AINEs inhiben la síntesis de prostaglandinas renales, las cuales juegan un rol de apoyo en el mantenimiento de la perfusión renal. En los pacientes cuyo flujo sanguíneo renal o volumen sanguíneo se encuentre disminuido, la administración de un AINE puede precipitar una evidente descompensación renal, la cual es típicamente seguida del retorno al estado anterior al tratamiento tras la suspensión de la terapia antiinflamatoria no esteroidea. Los pacientes que presentan un mayor riesgo de tales reacciones son los pacientes ancianos, deshidratados, con insuficiencia cardíaca congestiva, cirrosis hepática, síndrome nefrótico y una evidente enfermedad renal, aquellos que hayan recibido un diurético, inhibidores IECA o antagonistas del receptor de angiotensina II o aquellos que se les haya practicado una intervención quirúrgica mayor y que hayan presentado hipovolemia. En estos pacientes el volumen de diuresis y la función renal deben ser cuidadosamente monitorizados desde el inicio del tratamiento. En raras ocasiones los AINEs pueden generar nefritis intersticial, glomérulonefritis, necrosis medular renal o síndrome nefrótico. La dosificación de MOBICOX® en pacientes con insuficiencia renal terminal con hemodiálisis, no debe ser mayor de 7,5 mg. No es necesario disminuir la dosificación en pacientes con insuficiencia renal de leve a moderada (p. ej., en pacientes con una depuración de creatinina mayor de 25 ml/min). Tal como sucede con la mayoría de los AINEs, se han reportado elevaciones ocasionales de las transaminasas séricas o de otros parámetros de la función hepática. En la mayoría de los casos éstas han sido pequeñas, pasajeras, superiores y cercanas a los límites normales superiores. Si tales alteraciones fueran significativas o persistieran, MOBICOX® debe ser descontinuado y deberán realizarse los exámenes correspondientes. No son necesarias las reducciones de la dosificación en pacientes con cirrosis hepática clínicamente estable. Los pacientes debilitados o frágiles generalmente toleran los eventos adversos en menor medida, por lo que deben ser vigilados cuidadosamente. Como sucede con otros AINEs deben tomarse precauciones especiales en pacientes de edad avanzada que son más propensos de presentar insuficiencia renal, hepática o cardíaca. La inducción de la retención de sodio, potasio y de líquidos, así como la interferencia con los efectos natriuréticos de los diuréticos pueden ser exacerbadas tras la administración de AINEs. Como resultado pueden precipitarse o exacerbarse tanto la insuficiencia cardíaca como la hipertensión arterial en pacientes susceptibles, por lo que en pacientes con este riesgo se recomienda su vigilancia continua. Como cualquier otro AINE monos cinomologosMOBICOX® puede enmascarar síntomas de una enfermedad infecciosa subyacente. El uso del meloxicam, al igual que con cualquier fármaco que inhiba la síntesis de ciclooxigenasas/prostaglandinas, puede interferir con la fertilidad por lo que no se recomienda en mujeres que pretendan concebir. Por lo tanto, se debe considerar la interrupción del meloxicam en mujeres con dificultad para concebir, o en aquellas que se encuentran bajo investigación de infertilidad. No existen estudios específicos acerca de los efectos sobre la capacidad para conducir vehículos o el uso de maquinaria. Los pacientes que experimenten alteraciones visuales, mareos u otros trastornos del sistema nervioso central deberán sustraerse de tales actividades. MOBICOX® tabletas de 7,5 mg contiene 47 mg de lactosa por dosis máxima diaria recomendada. Pacientes con problemas hereditarios raros de intolerancia a la galactosa, deficiencia de Lapp-lactasa o mal absorción de glucosa-galactosa no deberán tomar meloxicam. MOBICOX® tabletas de 15 mg contiene 20 mg de lactosa por dosis máxima diaria recomendada. Pacientes con problemas hereditarios raros de intolerancia a la galactosa, deficiencia de Lapp-lactasa o mal absorción de glucosa-galactosa no deberán tomar meloxicam.
Restricciones de uso durante el embarazo y la lactancia: MOBICOX® está contraindicado durante el embarazo y la lactancia. La inhibición de la síntesis de prostaglandinas puede afectar adversamente el curso del embarazo y/o el desarrollo embriofetal. Datos de estudios epidemiológicos sugieren un incremento del riesgo aumentado de aborto, de malformaciones cardíacas y gastrosquisis posterior al uso de inhibidores de la síntesis de prostaglandinas en etapas tempranas del embarazo. El riesgo absoluto para malformación cardiovascular se aumentó de menos de 1% hasta aproximadamente 1,5%. Por lo que el riesgo aumenta en relación con la dosis y el tiempo de duración de la terapia. En animales, la administración de inhibidores de la síntesis de prostaglandinas ha dado como resultado un incremento en la mortalidad fetal. Agregado a esto, existe un incremento en la incidencia de varias malformaciones, incluyendo cardiovasculares, las cuales han sido reportadas en estudios hechos en animales a los cuales se les administró inhibidores de la síntesis de prostaglandinas durante el período organogénico. Durante el tercer trimestre del embarazo todos los inhibidores de la síntesis de prostaglandinas pueden exponer al feto a: toxicidad cardiopulmonar (con cierre prematuro del conducto arterioso e hipertensión pulmonar). Disfunción renal, que puede progresar a falla renal con oligohidramnios. La madre y el neonato, en el final del embarazo: posibilidad de prolongación del tiempo de sangrado, los efectos antiagregantes pueden ocurrir inclusive con dosis bajas. Alargamiento del tiempo de labor, secundario a inhibición de las contracciones uterinas. No existe ninguna experiencia específica con MOBICOX®, pero se sabe que los AINEs son fármacos que son excretados por leche materna, por lo que su administración está contraindicada en mujeres que se encuentran en período de lactancia.
Reacciones secundarias y adversas: Los siguientes eventos adversos que pueden tener causa relacionada con la administración de MOBICOX® han sido reportados. Los eventos adversos que pueden estar causalmente relacionados a la administración de meloxicam han resultado de los reportes relacionados con la administración de medicamento comercializado rastreado por su número de referencia: alteraciones de los sistemas linfático y sanguíneo: conteo de células sanguínea anormal (incluido el conteo diferencial de células blancas), leucopenia, trombocitopenia, anemia. El uso concomitante con fármacos especialmente mielotóxicos, en particular con metrotexate, aparentemente es un factor predisponente para el desarrollo de una citopenia. Alteraciones del sistema inmune: reacción anafiláctica, reacción anafilactoide y otras reacciones de hipersensibilidad. Alteraciones psiquiátricas: estado confusional, desorientación y alteraciones del estado de ánimo. Alteraciones del sistema nervioso: mareo, somnolencia y dolor de cabeza. Alteraciones visuales: conjuntivitis, alteraciones visuales incluyendo visión borrosa. Alteraciones de oído y del sistema coclear: vértigo, tinnitus. Alteraciones cardíacas: palpitaciones. Alteraciones vasculares: incremento de la presión sanguínea, ruborización. Alteraciones del sistema respiratorio, torácico y mediastinol: asma en individuos alérgicos al ácido acetilsalicílico u otro AINE. Alteraciones gastrointestinales: perforación gastrointestinal, hemorragia gastrointestinal oculta o macroscópica, úlcera gastroduodenal, colitis, gastritis, esofagitis, estomatitis, dolor abdominal, dispepsia, diarrea, náusea, vómito, constipación, flatulencia, eructos. Hemorragia gastrointestinal, ulceración o perforación pueden ser potencialmente fatales. Alteraciones hepatobiliares: hepatitis, alteración en las pruebas de función hepática (por ejemplo: aumento de transaminasas o bilirrubina). Alteraciones de la piel y tejido subcutáneo: necrólisis epidérmica tóxica, síndrome de Stevens-Johnson, angioedema, dermatitis bullosa, eritema multiforme, salpullido, urticaria, reacción de fotosensibilidad y prurito. Alteraciones renales y urinarias: insuficiencia renal aguda, pruebas de función renal anormales (incremento de creatinina sérica y/o urea sérica). El uso de AINEs puede estar relacionado con desórdenes de micción, incluyendo retención urinaria aguda. Alteraciones generales: edema.
Interacciones medicamentosas y de otro género: Otros inhibidores de la síntesis de prostaglandinas incluyendo glucocorticoides y salicilatos (ácido acetilsalicílico) en coadministración con inhibidores de la síntesis de prostaglandinas pueden incrementar el riesgo de úlcera y sangrado gastrointestinal por efecto sinérgico por lo que no se recomienda su combinación. La administración concomitante de aspirina (1.000 mg tres veces al día) a voluntarios sanos tendió a aumentar el área bajo la curva (10%) y la concentración máxima en plasma (24%) de meloxicam. Se desconoce la importancia clínica de esta interacción. Anticoagulantes orales; ticlopidina, heparina administrada por vía sistémica, trombolíticos e inhibidores selectivos de la recaptura de serotonina los cuales aumentan el riesgo de sangrado. Si tales prescripciones no pueden ser evitadas, se deben vigilar estrechamente los efectos de dichos anticoagulantes. Litio: la administración de AINEs se ha asociado al incremento de los niveles séricos de litio (por medio de una disminución de la excreción renal de litio), lo cual puede originar valores tóxicos. No se recomienda el uso concomitante de litio y AINEs. Si esta combinación es necesaria, se deben monitorear cuidadosamente las concentraciones de litio en plasma durante el inicio, ajuste e interrupción del tratamiento con meloxicam. Metotrexato: los AINEs pueden reducir la secreción tubular del metotrexato aumentando así la concentración de éste en plasma. Por esta razón, no se recomienda el uso concomitante de AINEs en pacientes con altas dosis de metotrexato (más de 15 mg/semana). El riesgo de interacción entre AINEs y el metotrexato se debe considerar también en pacientes con dosis baja de metotrexato, especialmente en pacientes con función renal alterada. En caso de ser necesaria la terapia concomitante, se debe monitorizar el conteo de glóbulos rojos en sangre y la función renal. Se debe tener cuidado en caso de que se administren concomitantemente el AINE y el metotrexato durante 3 días, en cuyo caso el nivel en plasma del metotrexato se puede incrementar y provocar con ello un aumento de la toxicidad. Aunque la farmacocinética del metotrexato (15 mg/semana) no se afectó en forma relevante por el tratamiento concomitante con el meloxicam, se debe considerar que la toxicidad hematológica del metotrexato se puede incrementar al administrarse de forma concomitante con AINEs. Anticonceptivos: con el uso de AINEs se ha reportado un descenso de la eficacia de dispositivos intrauterinos, pero se requiere de mayor información. Diuréticos: en pacientes deshidratados, el tratamiento con AINEs se ha asociado con un riesgo potencial de insuficiencia renal aguda. Los pacientes a los cuales se les administre MOBICOX® conjuntamente con un diurético deben ser adecuadamente hidratados y vigilados acerca de su función renal antes de iniciar el tratamiento. Antihipertensivos (ej., beta-bloqueadores, inhibidores de la ECA, vasodilatadores y diuréticos): se ha reportado una disminución en el efecto de los antihipertensivos debido a la inhibición de las prostaglandinas
